美国代理机构希望在批准Covid-19疫苗之前2个月的安全数据
美国食品和药物管理局周二发布了对Covid-19疫苗的紧急批准的指引,使其希望在试验志愿者有第二剂后两个月内希望看到随访。
因此,唐纳德特朗普总统的政府不太可能有一个疫苗在11月3日之前的市场上,总统经常说的是卡片。
“来自第3阶段研究的数据应包括在完成完整疫苗接种方案完成后至少两个月的中位随访期限,以帮助提供足够的信息来评估疫苗的益处风险概况,”该文件表示。
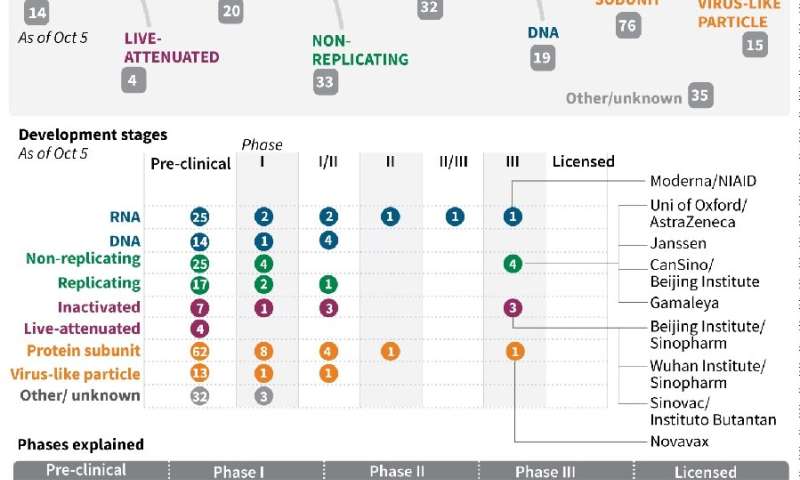
两家公司在他们身上最远的公司疫苗试验,现代和辉瑞公司,两者都开始于7月底的最后阶段,两者都需要两个单独的注射28天。
这意味着只有签署审判的前几个人将在10月底完成后续期间,并且可能没有足够的数据来申请紧急使用。
疫苗将不得不为所有患者接种对抗Covid-19的一半。此外,需要至少有五种严重感染病例安慰剂集团证明疫苗是有效的。
“FDA致力于使#Covid19疫苗开发过程和我们的科学评估尽可能开放和透明,”该机构的头斯蒂芬哈恩在Twitter上写道。
在白宫和FDA之间的拔河报告的情况下,发布指导的决定来自。
根据美国媒体网点,白宫浏览了两个月的随访时间,不必要,并不希望FDA实施它。
特朗普在周二晚上对Twitter表示不赞成,写作:“新的FDA规则使他们更加困难,以便在选举日之前加快疫苗批准。只是另一个政治打击工作!”
这些消息受到卫生专家欢迎的欢迎,他们表示,它表明该机构面对政治压力负责任地行事。
©2020 AFP.















用户评论