KDM5A和PHF2积极控制pro-metastatic基因的表达
表观遗传机制替代目标提供了机遇,但他们的贡献尤因肉瘤转移和疾病进展仍然知之甚少。
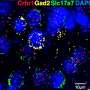
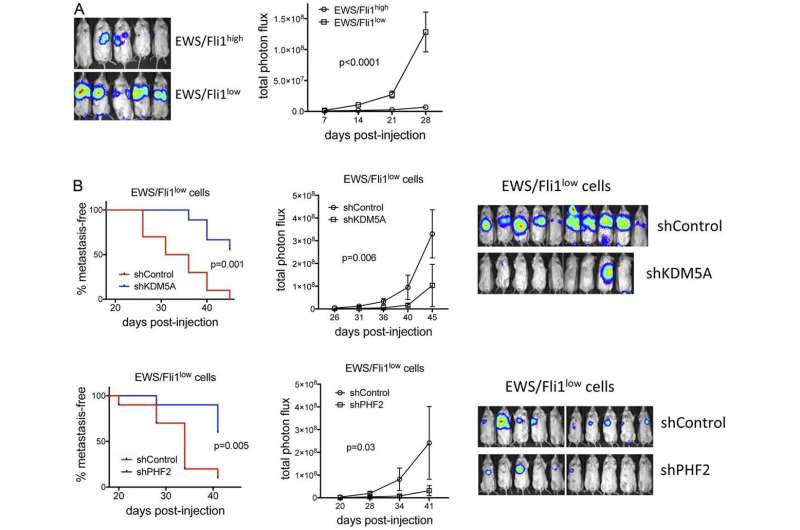
在这里,作者表明,表观遗传监管者KDM5A和尤因PHF2促进增长和转移性属性肉瘤,引人注目的是,激活表达许多pro-metastatic基因EWS / Fli1紧。这些基因包括L1CAM,与在尤因肉瘤不良预后相关,并促进迁移和侵袭性属性。
KDM5A和PHF2保持其增长促进作用更EWS / Fli1low metastatically有效细胞,PHF2促进入侵和L1CAM表达的细胞群。
综合来看,这些研究确定KDM5A诱发疾病和PHF2小说因素,和潜在的新目标,在尤因肉瘤,包括更多metastatically有力EWS / Fli1low细胞群。
科罗拉多丹佛大学的Paul Jedlicka博士说,“尤因肉瘤,骨和软组织的第二个最常见的癌症在儿童和年轻人,是生物和临床积极的恶性肿瘤,具有强烈倾向转移和糟糕的长期结果。”
通过这些和其他机制,EWS / Fli1戏剧性的改变基因表达及相关融合效果,驱动异常的细胞增殖和生存,对于肿瘤发生是必要的。
虽然EWS的角色/ Fli1作为异常的细胞增殖的司机,生存,致癌转换和肿瘤生长良好,不太了解的机制支撑的高转移性倾向尤因肉瘤。
值得注意的是,虽然EWS / Fli1带来积极的监管控制一些pro-metastatic基因和通路,多项研究表明,总的来说,EWS / Fli1施加高压影响重要的尤因肉瘤转移特性。
即EWS / Fli1:抑制细胞粘附、能动性和体外入侵;压制metastasis-promoting许多基因的表达;,抑制器官殖民和尾静脉注射模型体内转移发展。
有趣的是,最近的研究表明,EWS / Fli1表达式定量内异构patient-derived细胞系和肿瘤,与一些细胞表达高EWS / Fli1水平,和一些低水平表达。
“Jedlicka Oncotarget研究论文研究小组得出结论,我们的研究发现的存在表观遗传机制尤因肉瘤”
进一步探索