潜在的阿尔茨海默氏症的新疗法显示通过网络建模的复杂分子的相互作用
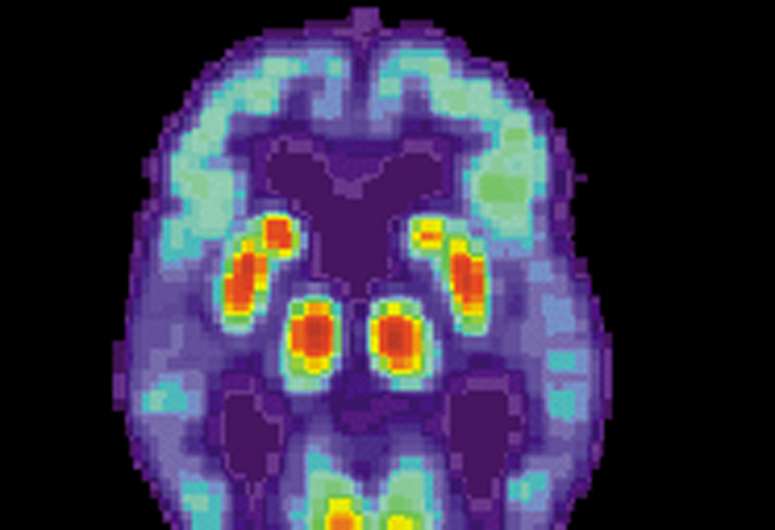
研究者从西奈山和国家老年病学中心和老年医学在日本已经确定了新的分子机制推动晚发性阿尔茨海默氏症(负载),以及一个有前途的治疗治疗候选人,据《华尔街日报》的一项研究神经元。负载是痴呆的最普遍形式在65岁以上的人,一个进步的和不可逆转的大脑紊乱影响超过550万人在美国和第六大死因。
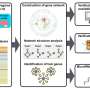
“我们的研究提出了负载发病机制的理解不仅揭示其全球结构,但详细的电路复杂的分子相互作用和法规在关键脑区受负载的影响,”第一作者本张说,博士,遗传学和基因组科学教授伊坎在西奈山医学院,中心主任的疾病模型。“我们创建的网络模型作为确定新的治疗目标的蓝图,直接回应迫切需要新的方法来预防、治疗、和延缓负载的发生。”
以前的遗传和全基因组关联研究(GWAS)已经确定了一些基因突变与负载有关,但疾病的因果变异一直无特征。探索发病的分子机制驱动负载,山Sinai-led团队进行一个综合网络生物学分析的全基因组和RNA序列数据集从多个大脑皮层区域数以百计的捐助者、健康和负载。这项工作揭示了成千上万的分子变化,发现许多特异性神经元基因子网负荷中特异表达。
从调查研究人员预言ATP6V1A蛋白质编码基因,在关键信号通路中起着重要作用在大脑中,而其赤字可以追溯到负载。连杆是评估使用两种方法:CRISPR-based技术操纵donor-matched ATP6V1A水平大脑细胞体外,RNAi-based击倒在转基因果蝇模型,即遗传物质是人为地引入飞行模型,研究特定基因沉默效应。事实上,击倒ATP6V1A恶化与负载有关的神经退化的模型。
同样重要的是,研究人员预测,药物化合物,NCH-51,可以在负载正常特异表达的基因,包括ATP6V1A,证明NCH-51显著提高ATP6V1A赤字的神经元和神经退行性的影响在这两个模型系统。具体来说,CRISPR-based实验用人类诱导多能干细胞(hiPSC)表明,镇压ATP6V1A,特别是结合β-amyloid-a关键AD-dramatically神经病理学的标志神经功能的影响。“我们创建的人性化系统被证明是一种很有前途的方法建模机制在负载等疾病风险和发展生活组织并不可用,”克里斯汀Brennand观察,博士,副教授,遗传学和基因组科学,西奈山,该研究的作者之一。
果蝇实验也揭示,证明ATP6V1A赤字加剧β-amyloid-mediated毒性和tau-mediated轴突退化。“这一发现表明,ATP6V1A可能广泛的神经保护作用和作为一个潜在的治疗目标为其他tau-related神经退行性疾病,”博士说Koichi m .饭岛爱,阿尔茨海默病研究部门主管全国老年与老年学中心在日本,和该研究的资深作者。
张博士指出,西奈山的突破性研究和日本合作伙伴可能意义不仅仅是负载。“我们已经创建了一个框架,用于先进建模复杂的人类疾病,”他解释说,“这很可能导致发现的分子机制和新靶点的识别能够带来变革性的新疗法。”