血管细胞与肥胖的慢性炎症有关
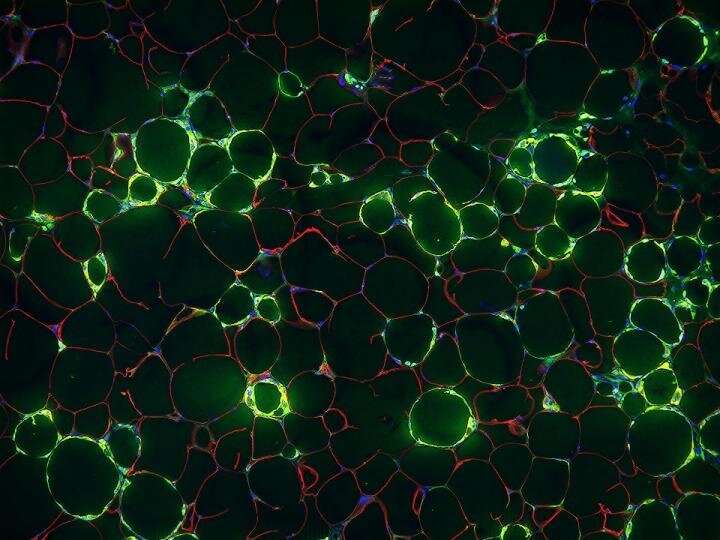
2020年12月30日—当体内的脂肪细胞充满多余的脂肪时,周围的组织就会发炎。这种慢性、低水平的炎症是许多与肥胖有关的疾病背后的驱动因素之一。现在,德克萨斯大学西南分校的科学家们发现了一种细胞,至少在老鼠身上,可以引发脂肪组织中的这种炎症。他们的研究结果发表在自然的新陈代谢这项研究最终可能会带来治疗肥胖的新方法。
“脂肪发炎细胞研究负责人、内科副教授拉纳·古普塔博士说:“与肥胖相关的许多合并症都与肥胖有关——癌症、糖尿病、心脏病和感染。”“通过识别这些细胞,我们在了解导致炎症的一些初始事件方面迈出了一步。”
当一个人摄入的卡路里超过所需时,多余的卡路里会以甘油三酯的形式储存在脂肪组织中,也称为白色脂肪组织(WAT)。研究人员知道,在肥胖人群中,WAT会过度劳累,脂肪细胞开始死亡,免疫细胞被激活。但这种炎症发生的确切机制尚不完全清楚。
许多研究都集中在信号分子由WAT中的脂肪细胞或免疫细胞产生,可能导致炎症,古普塔的团队采取了不同的方法。他们转而关注携带血液的血管免疫细胞和炎症分子——变成WAT。
2018年,古普塔和他的同事们在小鼠体内发现了一种新型的血管内衬细胞——脂肪祖细胞(APC),或前体细胞,它会继续生成成熟的脂肪细胞。但与大多数apc不同的是,这种被称为纤维炎症祖细胞(fips)的新细胞会产生刺激炎症的信号。在这项新研究中,研究人员更仔细地研究了FIPs在介导炎症中的作用。
在一天之内,把年轻的雄性老鼠换成了高脂肪饮食古普塔和他的同事发现,FIPs迅速增加了产生炎症分子的数量。在高脂肪饮食28天后,他们发现与其他apc相比,fip的比例大幅增加。
古普塔说:“这是第一个证明这些细胞在脂肪组织中作为炎症的看门人发挥非常积极的早期作用的研究。”
为了证明FIPs数量和活性的增加不仅仅是已经发炎的脂肪细胞的副作用,研究小组从一些小鼠的FIPs中去除了一个关键的免疫信号基因Tlr4。在高脂肪饮食5个月后,缺乏Tlr4的小鼠与其他高脂肪饮食的小鼠一样,体重增加了同样多的脂肪。但是经过基因工程改造的老鼠——fip不再能产生同样的信号——不再有高水平的炎症。相反,的水平炎性分子它们的WAT水平接近低脂饮食小鼠的水平。
Gupta和他的同事们继续表明,增加FIPs中相关信号分子ZFP423的水平也可以改善这种疾病炎症在鼠标脂肪细胞。这些发现为降低肥胖者患病风险指明了可能的途径。
古普塔说:“就减缓这些细胞中的炎症信号而言,ZFP423似乎是一个重要的刹车。”当然,这是否也适用于人类,还有待观察老鼠。"
古普塔的团队正在计划未来的实验,以更好地了解高脂肪的哪个方面饮食引发FIPs中炎症信号的增加,以及这一结果是否适用于人类脂肪。
进一步探索













用户评论