挖掘Duchenne肌营养不良症的差异
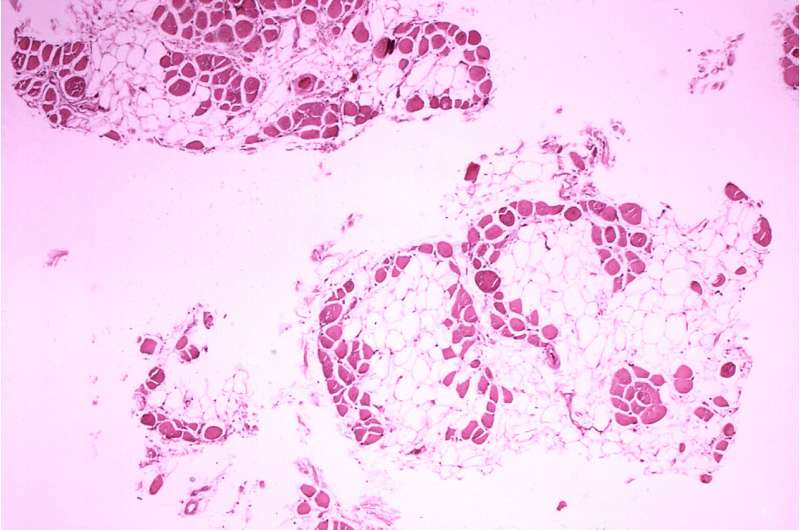
UT Southwestern研究团队在小鼠的骨骼肌中具有编目的基因活性,将健康动物与携带遗传突变的人进行比较,导致Duchenne肌营养不良(DMD)在人类中。最近在线发布的调查结果pnas.,可能导致这种破坏性退行性疾病的新疗法和影响影响肌肉发育的因素。
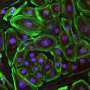
了解活动的基因可以脱落在体内影响不同组织的病理学上。然而,朗达巴塞尔 - 拜访,博士,在UTSW的分子生物学教授,学习骨骼肌由于其他组织类型的关键差异,这是一个挑战;而不是含有控制基因活性的单个核,而不是骨骼肌肉纤维可以包含数百个核。并且它未知在所有这些细胞核中激活哪种基因,使得尚不清楚基因表达在受DMD影响的健康骨骼肌组织和组织之间的不同之处。
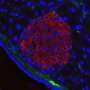
回答这些问题,埃里克奥尔森,博士,博士,博士,博士 - 拜特,兼胫塞尔和他们的同事从胫骨上孤立的组织,一只小鼠的肌肉,类似于胫骨的人类。他们从健康动物中和DMD的小鼠模型中取出了这些样本,即它们使用基因编辑技术产生的突变,以引入通常导致人们DMD的突变。然后,研究人员从两组肌肉纤维中分离出两组动物的肌肉组织,科学家基于类似的基因谱确定14种核。这些核似乎基于其主要的占主导地位执行不同的工作基因活动,例如维持成熟肌肉,与神经元或肌腱一起联络,或再生新的肌肉纤维。研究人员还确定了其他类型细胞的细胞核,例如平滑肌细胞,内皮细胞,产生脂肪或结缔组织的细胞,以及称为巨噬细胞的免疫细胞。
当研究人员在健康和DMD小鼠之间比较了这14个不同核的群体时,他们发现显着的差异。例如,与健康动物相比,DMD的人具有明显较少的成熟肌肉核。相反,它们具有更大的巨噬细胞,反映了DMD肌肉中存在的炎症,以及根本不存在于健康组织中的再生细胞类别。核心参与与神经相互作用细胞和肌腱有最差异基因表达两组之间,表明它们受到所有核类型的DMD受影响最大的影响。
此外,从DMD动物中分离的几乎所有肌肉核在泛素途径中增加了基因活性,该途径在蛋白质中标记了蛋白质以降解,以及在凋亡中起作用的基因的较高激活,或者细胞死亡反映肌肉的降解表征DMD。
Bassel-douby注意到该研究有几个关键限制:例如,所使用的技术没有揭示肌肉细胞核位于肌肉组织内的位置,这可能会赋予核如何相互通信的有价值的线索并影响基因活动。如果修补导致DMD可能将基因激活恢复到正常的基因突变,也仍然未知。她和她的同事计划在未来的研究中调查这些问题。
通过制定更好地理解肌肉纤维如何在健康和患病中运作组织她补充说,研究人员最终可以学会操纵基因活动以获得最佳水平。作为一种更直接的目标,鉴定DMD患者的差异可能导致新的治疗目标。
“鉴定这些中的特定基因活动核心Bassel-Duby说,可以给我们以前被忽视的治疗的新想法。“最终,我们最终可以找到防止这些患者肌肉从退化和改善他们生活质量的方法。”
“我们的研究为Duchenne肌营养不良的分子底划处于前所未有的分辨率水平,并突出了这种疾病中的中央角色的基因和信号通路的集合,”添加了Olson。“这项工作开辟了通过药理或遗传干预改善这种疾病严重病理学后果的新方法。”
进一步探索











用户评论