FDA批准销售ACL植入物
(HealthDay)—An anterior cruciate ligament (ACL) implant that offers an alternative to traditional ACL reconstruction has received marketing authorization from the U.S. Food and Drug Administration—the first approval for an ACL tear treatment in more than 30 years, the agency announced yesterday.
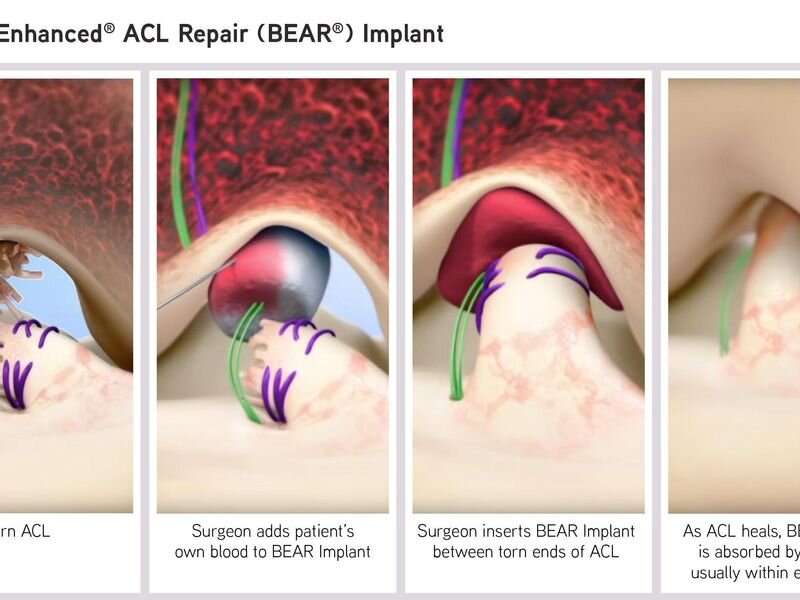
Bridge-Enhanced ACL Repair (BEAR)植入物获得了De Novo上市前审查途径的批准,这是FDA对一种新型低到中风险设备的监管途径。这种由牛胶原蛋白制成的可吸收植入物是目前唯一可用的替代品重建使用同种异体移植,自体移植或仅用于ACL破裂的修复。对至少14岁的骨骼成熟患者表示批准,在磁共振成像上确认完全ACL破裂。ACL树桩必须连接到胫骨以构建修复。
外科医生通过缝合固定BEAR植入物,并将患者自己的血液注射到植入物中,形成一个设备保护的凝块,从而使身体的愈合过程得以进行。根据美国食品药品管理局的说法,手术后大约八周内,植入物就会被人体自身组织吸收和替换。
BEAR种植体的批准是基于BEAR II临床试验的数据,显示该种植体对14- 35岁患者ACL重建的非劣势性。在100例完全ACL破裂患者的随机对照试验中,65例患者接受了BEAR种植体,35例患者接受了a控制组采用自体移植物进行ACL重建。两年后,国际膝关节文献委员会的平均主观评分分别为BEAR种植体组和对照组的88.6和84.6。在两年的关节测量评估中,接受了BEAR植入的患者的平均松弛度比未接受治疗的患者的平均松弛度大1.7 mm,而对照组患者的平均松弛度大1.8 mm。
营销授权被授予米西奥托洛普德国公司。该公司表示计划进行有限的市场释放注入在2021年初。
进一步探索
版权©2020健康天。版权所有。









用户评论