FDA批准EndoRotor系统上市

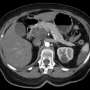
美国食品和药物管理局给了内泻物系统授予营销授权,该系统提供了一种微创方式,用于去年围绕围岩胰腺坏死(WOPN)的患者切除和去除坏死组织。
FDA称,该批准为15%的严重胰腺炎患者同时发展为WOPN提供了一种新的治疗选择。目前的治疗方法包括侵入性手术或内镜工具,并不是专门用于治疗WOPN。EndoRotor系统用于直接内镜下的坏死切除术,只能在其他手术引流WOPN后使用。
FDA基于营销授权批准的安全性和有效性数据来自30名WOPN患者的试验,该患者与使用内镜系统进行直接内窥镜病变术的患者。共有63个程序,平均每位患者2.1。基于成像数据,研究人员发现在程序后每位患者胰腺的坏死组织量的平均降低了85%;一半的患者减少了98.5%坏死组织。
三名患者报告了与该程序相关的严重不良事件:两个人胃肠道出血第三个是一种气球,后来患有败血症和多器官系统失败后死亡,由于大量感染的胰腺坏死。其他严重的不良事件包括吐血,深静脉血栓形成和胰腺炎;所有这些都归咎于患者的潜在状况,而不是设备。FDA要求对已知或疑似胰腺癌患者使用该设备发出黑框警告。对于腔内假性动脉瘤大于1cm的患者、介入胃静脉曲张的患者或通路内不可避免的血管患者,也禁忌使用该设备。
该设备的销售许可已授予Interscope。
进一步探索
版权©2020健康天。版权所有。















用户评论