FDA批准用于前列腺癌PET成像的药物

(健康日) - 美国食品和药物管理局批准了本机构前列腺癌前列腺特异性膜抗原(PESMA)阳性病变的第一种用于正电子发射断层扫描(PET)成像的药物。
批准放射性诊断剂镓68 PSMA-11(GA 68 PSMA-11)被授予加州大学洛杉矶(UCLA)和加州大学旧金山及其核医学队。批准为医生提供了一种新的成像方法来检测前列腺癌在全身病人怀疑有转移或复发的基础上上升前列腺特异性抗原(PSA)的水平。
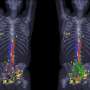
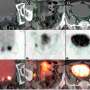
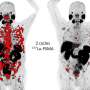
FDA基于两项前瞻性临床试验的安全性和疗效数据的批准。第一次试验包括325名活检验证前列腺癌的患者,他是手术腺体和盆腔淋巴结的外科手术候选者,并且具有高的转移风险。患者接受了PET /计算机断层扫描(CT)或PET /磁共振成像(MRI)扫描扫描GA 68 PSMA-11的单一静脉注射。手术病理证实,GA 68 PSMA-11 PET上盆腔淋巴结中具有阳性读数的那些具有临床重要的转移性癌症。
第二项研究,发表在JAMA肿瘤学去年6月,涉及635名疑似前列腺癌癌症复发,基于血清PSA水平上升,所有这些都接受了单一GA PSMA-11 PET / CT扫描或PET / MRI扫描。扫描显示,74%的患者在至少一个体内至少有一个阳性病变。在估计的91%的患者患者中诊断出患有正面GA PSMA-11宠物读数的局部复发或转移。研究人员报告了高积极的预测价值,检测率和中等地位协议。
“因为PSMA PET扫描已经被证明在定位这些肿瘤方面更有效,它应该成为男性前列腺癌治疗的新标准癌症在一份声明中,对于初步分期或复发的初始分期或统一,“耶和华甘蓝·林登医学院的M.D。
FDA注意到GA 68 PSMA-11没有严重的不良反应。最常见的不良反应是恶心,腹泻和头晕。误诊也是GA 68 PSMA-11的风险,因为结合可能在其他类型的癌症中发生并且具有可能导致图像解释误差的某些非开始过程。
版权©2020健康天。版权所有。











用户评论