肥胖损害免疫细胞功能,加速肿瘤生长
肥胖与十几种不同类型的癌症的风险增加,以及更差的预后和生存率有关。多年来,科学家们已经确定了与肥胖有关的驱动肿瘤生长的过程,如代谢变化和慢性炎症,但对肥胖和癌症之间相互作用的详细了解仍然难以捉摸。
现在,在一项针对小鼠的研究中,哈佛医学院的研究人员发现了这一谜题的新部分,对癌症免疫疗法产生了令人惊讶的影响:肥胖使癌细胞在竞争中胜出瘤杀死免疫细胞在一场燃料之战中。
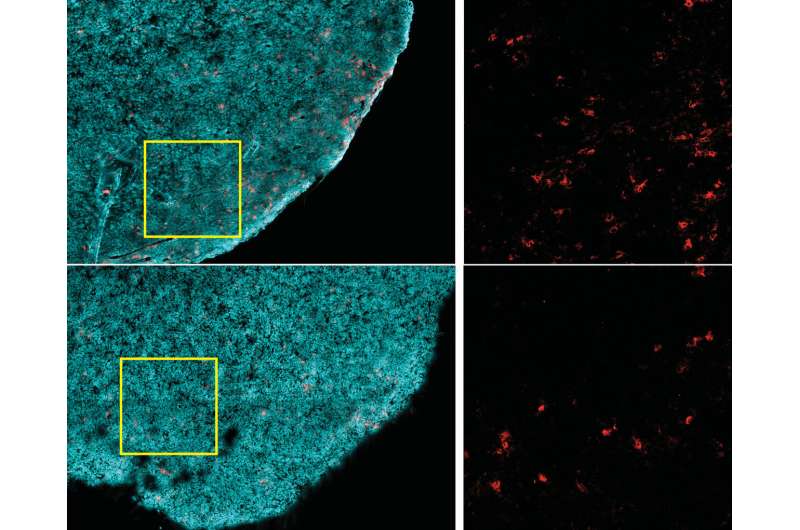
在报告细胞12月9日,研究小组发现高脂肪饮食会减少肿瘤内CD8+ T细胞的数量和抗肿瘤活性,CD8+ T细胞是一种关键的免疫细胞。这是因为癌细胞会根据增加的脂肪可用性重新调整新陈代谢,以便更好地吞噬富含能量的脂肪分子,从而剥夺T细胞的能量,加速肿瘤的生长。
“将同样的肿瘤放入肥胖和非肿瘤中揭示癌细胞以响应高脂饮食而重新丝的代谢,”在研究的HMS和联合高级作者的Blavatnik学院的细胞生物学教授Marcia Haigis说。“这一发现表明,在一个环境中可能工作的治疗可能不会在另一个环境中有效,这在我们社会中患有肥胖疫情需要更好地理解。”
研究小组发现,阻断这种与脂肪相关的代谢重编程,可以显著减少高脂肪饮食的小鼠的肿瘤体积。由于CD8+ T细胞是激活免疫系统对抗癌症的免疫疗法的主要武器,研究结果提出了改进这种疗法的新策略。
“癌症免疫疗法对患者的生活产生了巨大的影响,但并不是每个人都能从中受益。”
“我们现在知道T细胞之间存在一种代谢拔伤疣肿瘤细胞这种情况会随着肥胖而改变,”夏普说。“我们的研究为探索这种相互作用提供了一个路线图,这可以帮助我们开始以新的方式思考癌症免疫疗法和联合疗法。”
Haigis,Sharpe及其同事调查了肥胖对不同类型癌症的小鼠模型的影响,包括结肠直肠,乳腺,黑色素瘤和肺。由学习联合主导作者艾莉森··林格尔和杰伊特·德累斯维斯,球队给了小鼠正常或高脂肪饮食,后者导致体重增加和其他肥胖有关的变化。然后他们看着肿瘤内外的不同细胞类型和分子,一起称为肿瘤微环境。
脂肪悖论
与正常饮食相比,研究人员发现肿瘤在高脂饮食中的动物中越来越快地增长。但这仅发生在免疫原性的癌症类型中,这可以含有大量的免疫细胞;更容易被免疫系统认可;更有可能引起免疫反应。
实验表明,与饮食相关的肿瘤生长差异具体依赖于CD8+ T细胞的活性,CD8+ T细胞是一种能够靶向并杀死癌细胞的免疫细胞。如果小鼠实验中消除CD8+ T细胞,饮食并不影响肿瘤的生长速率。
值得注意的是,高脂肪饮食减少了肿瘤微环境中CD8+ T细胞的存在,但没有在身体其他地方。那些留在肿瘤里的人更不健壮——他们分裂得更慢,并且有活性降低的标志。但当这些细胞被分离并在实验室中生长时,它们的活动正常,这表明肿瘤中有什么东西损害了这些细胞的功能。
研究小组还遇到了一个明显的悖论。在肥胖动物中,肿瘤微环境中主要的游离脂肪酸(一种主要的细胞燃料来源)被耗尽,即使身体的其他部分富含脂肪,正如肥胖动物所预期的那样。
这些线索促使研究人员制作了一个全面的图谱,显示正常饮食和高脂肪饮食条件下肿瘤中不同细胞类型的代谢图谱。
分析显示,癌细胞会对脂肪利用率的变化做出反应。在一个高脂肪饮食而CD8+ T细胞则不能。这最终耗尽了肿瘤微环境中的某些脂肪酸,使T细胞缺乏这种必要的燃料。
脂肪酸消耗这种矛盾的现象是这项研究中最令人惊讶的发现之一。它真的震撼了我们,它是我们分析的发射台,”海格斯实验室博士后林格尔说。“肥胖和全身代谢可以改变肿瘤中不同细胞利用燃料的方式,这是一个令人兴奋的发现,我们的代谢图谱现在允许我们解剖和更好地理解这些过程。”
热的和冷的
通过几种不同的方法,包括单细胞基因表达分析、大规模蛋白质调查和高分辨率成像,该团队确定了肿瘤微环境中癌症和免疫细胞代谢途径的许多饮食相关变化。
特别有趣的是PHD3,这是一种在正常细胞中被证明可以抑制过度脂肪代谢的蛋白质。与正常环境相比,肥胖环境中的癌细胞的PHD3表达明显降低。当研究人员强迫肿瘤细胞过表达PHD时,他们发现肥胖老鼠体内的肿瘤吸收脂肪的能力被削弱了。它还恢复了肿瘤微环境中关键游离脂肪酸的可用性。
增加的PHD3表达在很大程度上扭转了a的负面影响高脂肪饮食论肿瘤中免疫细胞功能。与具有低PHD3的肿瘤相比,具有高pHD3的肿瘤在肥胖小鼠中增长。这是CD8 + T细胞活性增加的直接结果。在缺乏CD8 + T细胞的肥胖小鼠中,肿瘤的生长不受PHD3表达的差异影响。
该团队还分析了人类肿瘤数据库,发现低PHD3表达与免疫“冷”肿瘤有关,“冷”肿瘤指的是免疫细胞数量较少。作者说,这种关联表明,肿瘤脂肪代谢在人类疾病中发挥着作用,肥胖降低了多种癌症的抗肿瘤免疫。
“CD8 + T细胞是许多有前途精确癌症疗法的中央焦点,包括疫苗和诸如CAR-T的细胞疗法,”Sharpe说。“这些方法需要T细胞具有足够的能量来杀死癌症细胞,但同时我们不希望肿瘤有燃料生长。我们现在具有令人惊讶的全面数据,用于研究这种动态和确定机制,以防止T细胞随着它们的运作。“
作者说,更广泛地说,这些结果为更好地理解肥胖如何影响癌症以及患者新陈代谢对治疗结果的影响提供了基础。他们说,虽然现在说PHD3是否是最好的治疗靶点还为时过早,但这些发现为通过代谢弱点来对抗癌症的新策略打开了大门。
“我们感兴趣的是确定我们可以用来作为潜在目标来预防的途径癌症海格斯说。“我们的研究提供了一个高分辨率的代谢图谱,可以深入研究肥胖、肿瘤免疫以及免疫和肿瘤之间的相互影响和竞争。细胞。可能还有许多其他类型的细胞参与其中,还有更多的途径有待探索。”
进一步探索














用户评论