科学家发现了促进血管动脉化的细胞和分子机制
科学家在心血管群(CNIC)中进行的研究促进了对血管生物学的理解,并为设计新的治疗策略的设计指向诱导血管形成和更有效的受伤或缺血性组织的血液灌注。
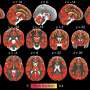
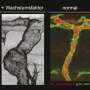
这项研究由鲁伊·贝尼多(Rui Benedito)领导,发表在自然,揭示了一种新的细胞和分子机制对于发展动脉来自血液毛细血管,这一过程称为动脉化。这种机制的激活可以改善瞬时或长期减少心脏血流后心脏功能的恢复。
到目前为止,据信血管动脉化取决于祖细胞到动脉细胞的分化和规范,该过程被认为需要转录激活和DNA重塑。新发现表明,动脉化涉及及时抑制新陈代谢和细胞周期,并且这一事件既需要触发动脉的分化和发展,既是必要又足够的。
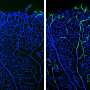
在过去的20年中,科学家发现了几种细胞和分子机制,这些机制对于动脉和静脉的形成和分化至关重要。在任何生长器官中开发的第一个血管都不成熟,并形成一个未分化和基本的血管网络,称为前体血管丛。该网络是由内皮细胞并且在运输血液方面相对效率低。它可以比作为当地交通建立的道路网络,但缺乏较大的连接高速公路系统。
因此,由较大的传导动脉和静脉组成的分层血管系统的形成对于有效地从组织中和组织中有效运输至关重要。“该系统的不正确发展导致早产死亡或与之相关的潜在致命疾病血管畸形这可能导致中风,氧气供应不足或组织灌注不足。”
正确的动脉规范的起始需要激活两种遗传途径:VEGF和Notch信号通路。“ Notch是一种分子信号传导途径,直接调节改变细胞生物学的巨大基因的转录。当在内皮细胞中未激活Notch时,动脉规范和发育就会失败,仅保持毛细血管和静脉内皮细胞,” RUI说。”贝尼多。
这导致了这样一种观点,即通过在内皮细胞的一部分中诱导高度保守的遗传变化依赖性遗传变化程序来构建动脉。该遗传程序被认为对于内皮细胞区分,迁移和形成动脉的能力至关重要。
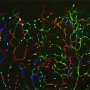
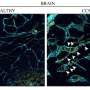
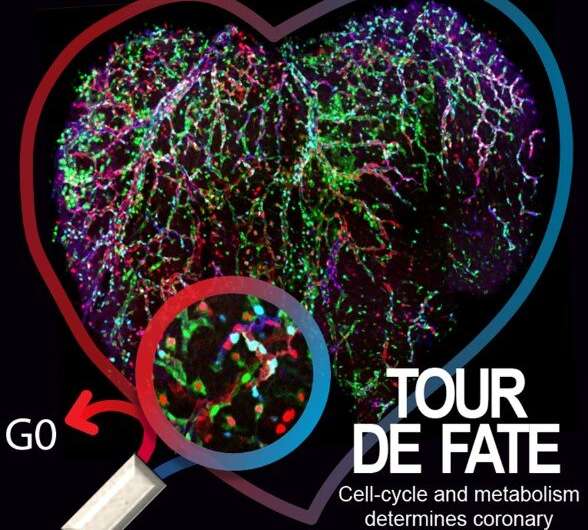
使用复杂的鼠标模型,单元成像和命运映射工具,Rui Benedito的组现在发现,具有独特的缺口信号传导水平的细胞对特定的命运有偏见,但不能在遗传上预先确定,因为如果将其放置在不同的动力学命运中,则可以将其放置在遗传上。适当的生物物理环境。
第一作者Wen Luo发现,VEGF和Notch在动脉化内皮细胞中的主要功能是抑制MYC,抑制其促进细胞增殖和代谢的能力。研究表明,MYC抑制是必要的,足以诱导动脉化有效偏见。
结果对于使用药物来增加缺血性心血管疾病中的血管生成也具有重要意义。该研究表明,刺激普通血管增殖的促血管生成药物将抑制动脉化。“我们未来的目标之一将是确定仅在动脉前中替代扩散信号的新方法细胞,从而促进有效的动脉化,而不会负面干扰毛细血管血管生成。” Rui Benedito说。
从翻译的角度来看,作者得出的结论是,调节动脉或静脉身份的能力血液血管对治疗冠状动脉疾病和心肌梗塞的治疗非常感兴趣。获得的结果可能导致新型治疗方法在缺血性心血管疾病中诱导有效的动脉化。
进一步探索