突变P53靶向复合APR-246解开癌细胞死亡的多方型癌细胞死亡机制
肿瘤病理学系的Sophia Ceder和Klas Wiman及其同事与来自墨尔本大学、剑桥大学和Aprea Therapeutics的研究人员一起在《科学》杂志上发表了一项研究EMBO分子医学这为突变p53靶向化合物APR-246的机制提供了新的认识。
大约一半的肿瘤携带肿瘤抑制基因TP53中的突变,其通常与预后差有关。该分子4月20日(Eprenetapopt)由Wiman及其同事于20年前(Bykov等人2002)发现,并且今天是临床上最先进的化合物,靶向突变P53。目前,APR-246正在进行突变体TP53中的III期临床试验骨髓增生异常综合征(MDS)和一些II期研究的各种适应症。今年早些时候,APR-246与Azacitidine联合治疗突变TP53 MDS获得了FDA突破性治疗指定,最近还获得了突变TP53急性髓系白血病(AML)的FDA快速通道指定。
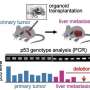
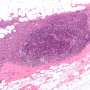
该研究调查了4月246日的多方面作用机制,提高治疗疗效,并提高了对癌细胞中4月246例药效学的理解。APR-246目标突变体P53并诱导氧化应激通过结合谷胱甘肽(GSH)或抑制抗氧化酶,这两者都是apr -246介导的癌细胞死亡的主要机制。APR‐246活性转化产物MQ与主要抗氧化剂谷胱甘肽形成可逆共轭。研究表明,该复合(GSH bound-MQ)可以通过多药耐药性- 分配的蛋白质1(MRP1)流出泵,阻断MRP1捕获MQ内部癌细胞。这形成了细胞内药物储层,其可以增强突变体P53的靶向并破坏细胞内氧化还原平衡。阻断MRP1与APR-246组合扩展治疗窗口,并在患有患者衍生的有机体和小鼠中,在患者衍生的有机体中的体外,在患者衍生的有机体和肿瘤异种移植物中的小鼠中发出协同癌细胞死亡。
总之,该研究解释了4月246和MQ的动态癌细胞表明MRP1在对APR‐246的敏感性中起关键作用。总之,我们的研究结果表明,APR‐246和靶向氧化还原平衡的药物联合治疗可能会更有效癌症治疗。
进一步探索












用户评论