LCMC3:新辅助药物atezolizumab是安全的,符合主要终点的病理应答率
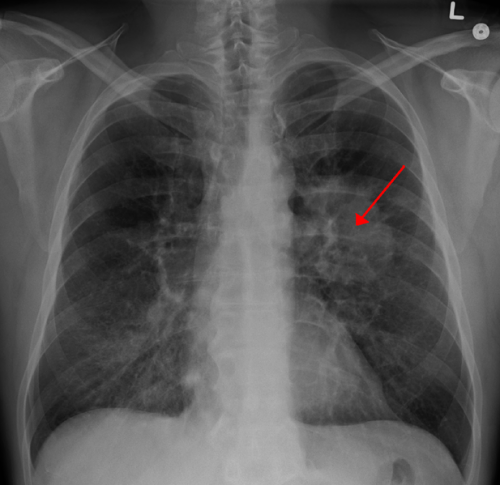
肺癌突变联盟(LCMC) 3研究的初步分析显示,肺癌手术前的新辅助药物atezolizumab具有良好的耐受性,符合其主要终点20%的主要病理缓解率。根据今天在国际肺癌研究协会的世界肺癌会议上提出的研究。
洛杉矶罗纳德·里根加州大学洛杉矶分校医学中心胸外科主任Jay M. Lee博士今天报告了一项对181例IB - IIIB期非恶性肿瘤患者的研究结果小细胞肺癌(NSCLC)患者每3周静脉注射1,200毫克的新辅助药物atezolizumab,共2个周期,术后切除。Atezolizumab是一种单克隆抗体,于2020年被美国食品和药物管理局批准用于成人转移性NSCLC患者的一线治疗。
Lee博士早些时候曾报道,小型试点研究(N Engl J Med. 2018;378:1976)表明,术前免疫检查点抑制剂治疗可能对可切除的NSCLC有益。Lee博士说:“LCMC3研究是在可切除的NSCLC中最大的检查点抑制的单药治疗试验,是比较未来结果的里程碑式研究。”
患者接受两个周期的新辅助atezolizumab治疗,然后在第一个周期后的30 - 50天内切除。从治疗中获益的患者继续辅助使用atezolizumab 12个月。主要终点是主要病理反应(MPR;在没有EGFR或ALK突变的患者中,小于或等于手术时存活肿瘤细胞的10%)。
在纳入的181例患者中,中位年龄为65岁;51%为女性,90%为当前或以前的吸烟者,62%为非鳞状组织。患者分为以下阶段:17例患者在IB分期;IIA 20例,IIB 55例,IIIA 72例,IIIB 17例。
在接受手术的无EGFR/ALK突变的患者中,主要病理应答率为21% (30/144;95% CI: 14%-28%),病理完全缓解率为7% (10/144;95%置信区间:3% - -12%)。
“重要的是认识到术前和术中LCMC3的不可切除率与历史上的新辅助化疗试验相当,不应引起关注,”Lee博士说。atezolizumab治疗后,术前181例中只有22例(12%)检测到不可切除性,术中159例中有7例(4%)检测到不可切除性。大多数患者(151/159;95%的患者接受了解剖肿瘤切除术,101例中只有15例(15%)接受了开胸手术。155例中有66例出现病理分期下降(%)。在159名患者中只有19人(12%)在手术时间之外进行了手术。
术中并发症少见(5/159;其中145例(92%)完全切除(R0)。术后不良反应与切除标本中存活肿瘤细胞较少有关。30天和30至90天的死亡率分别为1 / 159(0.6%)。
“后新辅助atezolizumab在新辅助治疗完成后,手术切除是安全的,围手术期发病率和死亡率很低,很少超出方案窗口,而且完全切除率很高。“这些发现代表了对已完成的LCMC3研究的初步分析,并与我们之前的结果一致,包括a初步报告在这些的一部分上病人[在]2019。”
临时IASLC CSO的Scagliotti博士说:“在多学科方法中整合免疫治疗和靶向治疗是早期NSCLC的优先事项。”“IASLC目前正在通过多项举措促进国际合作。”
进一步探索











用户评论