研究人员将细胞运输途径与侵略性脑癌联系起来
麦吉尔大学的研究人员已经确定了一种新的细胞途径,该途径通过控制细胞表面受体蛋白的回收来限制脑肿瘤的生长和扩散。该研究将于1月14日在细胞生物学杂志((JCB)表明,涉及一种称为RAB35的蛋白质的途径在许多胶质母细胞瘤患者中有缺陷,并且恢复Rab35的活性可能是这种致命的脑癌形式的新治疗策略。
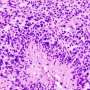
胶质母细胞瘤是最具侵略性的脑癌类型,并且由于它在很大程度上无法治疗,因此平均患者在诊断后的14个月内死亡。像其他癌症一样,胶质母细胞瘤细胞取决于细胞外部的各种受体蛋白。这些受体蛋白的水平受细胞运输途径的控制受体然后将它们降解或返回到细胞表面。
正常健康细胞,这些运输途径由一类称为小GTP酶的蛋白质调节。麦吉尔大学(McGill University)神经退行性疾病研究小组彼得·S·麦克弗森(Peter S. McPherson)说:“我们以前证明了一个称为RAB35的小GTPase的水平降低了。”“因此,我们试图研究Rab35在胶质母细胞瘤进展中的作用。”
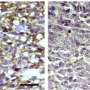
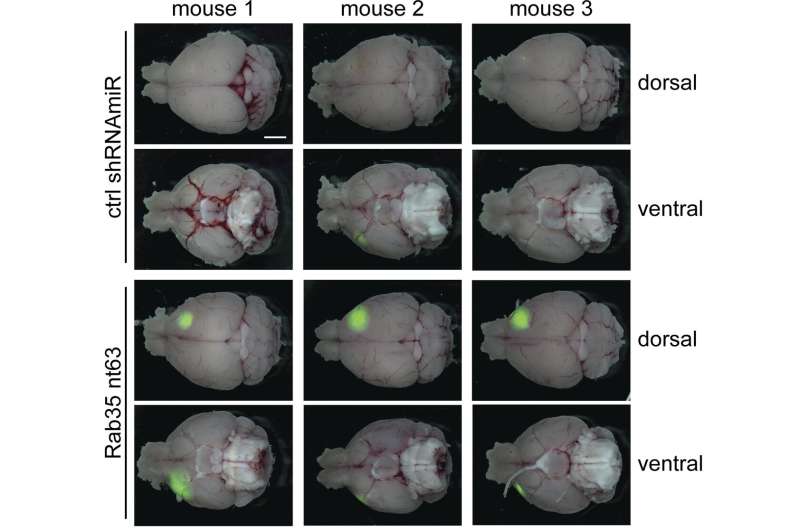
麦克弗森(McPherson)及其同事发现,降低RAB35的水平增加了小鼠脑肿瘤的生长和扩散,从而缩短了动物的寿命。相反,升高RAB35水平降低肿瘤生长并延长了动物的生存。
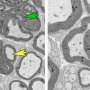
研究人员发现,Rab35被涉及另一个称为ARF5的小型GTPase的途径激活。一起,ARF5和RAB35似乎控制了各种细胞表面受体的运输,从而限制了细胞通过组织迁移和侵袭的能力,并限制了脑肿瘤发射细胞复制的能力。
该途径控制的细胞表面受体之一是信号蛋白表皮生长因子受体(egfr)。在胶质母细胞瘤中细胞缺乏RAB35,EGFR越来越多地回收到细胞表面,而不是降解,从而增强了受体的信号传导活性。用癌症药物抑制EGFR降低了一种称为SPOCD1的蛋白质的产生,该蛋白质已知可促进多种癌症的增殖和/或转移。
McPherson及其同事表明,恢复RAB35的活性可能会通过改变多重降解和回收利用来限制胶质母细胞瘤的发展细胞表面受体,包括EGFR。
麦克弗森说:“ RAB GTPases正在成为癌症中重要的新药物靶标。”“我们的研究揭示了RAB和ARF蛋白之间的前所未有的联系,并确定了用于胶质母细胞瘤治疗干预的新基因座。”
进一步探索