小鼠研究发现早产儿肠道疾病和脑损伤之间存在联系
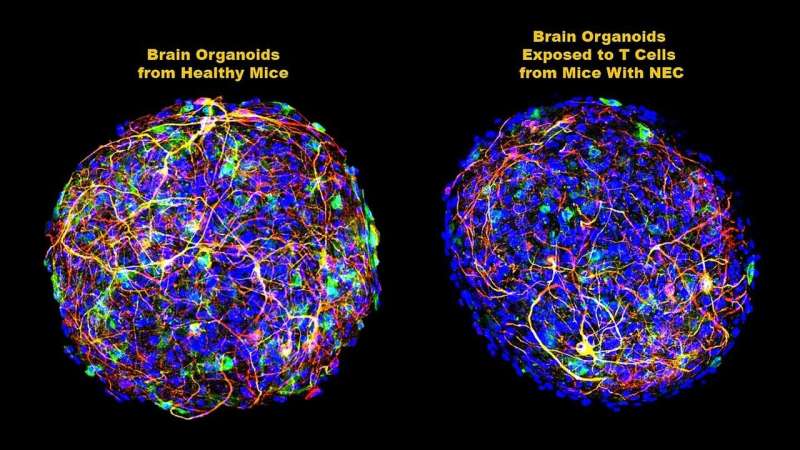
医生们早就知道坏死性小肠结肠炎(NEC)是一种潜在的致命炎症,会破坏早产儿的肠粘膜,通常与那些幸存下来的婴儿严重的脑损伤有关。然而,患病肠道将其破坏“传达”给新生儿大脑的方式在很大程度上仍然未知。
现在,和老鼠在美国,约翰霍普金斯医学院和瑞士洛桑大学的研究人员已经发现了缺失的一环——一种免疫系统细胞,他们说这种细胞从肠道传播到大脑,攻击细胞,而不是像正常情况下那样保护细胞。
该团队的研究结果发表在2021年1月6日的杂志上科学转化医学.
在出生时体重不足3.5磅的婴儿中,多达12%的人患有NEC,这是一种快速进展的胃肠道急症,细菌侵入结肠壁,引起炎症,最终破坏该部位的健康组织。如果足够多的细胞坏死(死亡),从而在肠壁上形成一个洞,细菌就会进入血液,导致危及生命的败血症。
在2018年的一项小鼠研究中,约翰·霍普金斯医学院和弗雷德·哈钦森癌症研究中心的研究人员发现,患有NEC的动物会产生一种名为toll样受体4 (TLR4)的蛋白质,这种蛋白质与肠道中的细菌结合,并加速肠道的破坏。他们还确定TLR4同时激活免疫细胞在大脑中被称为小胶质细胞,导致白质损失,脑损伤认知功能下降。目前尚不清楚这两者之间有何联系。
在这项最新的研究中,研究人员推测CD4+ T淋巴细胞——免疫系统细胞,也被称为辅助性T细胞——可能是其中的联系。CD4+ T细胞之所以被称为“助手”,是因为它们帮助另一种称为B淋巴细胞(或B细胞)的免疫细胞对被细菌或病毒等外来入侵者感染的细胞表面蛋白质-抗原作出反应。在CD4+ T细胞的激活下,未成熟的B细胞要么变成浆细胞,产生抗体,标记受感染细胞,以便从体内清除,要么成为记忆细胞,“记住”抗原的生物化学,以便对未来的入侵做出更快的反应。
CD4+ T细胞还会发出化学信使,将另一种类型的T细胞——即杀伤T细胞——带到该区域,这样就可以清除靶向感染细胞。然而,如果这种活动发生在错误的地点或错误的时间,这些信号可能会在不经意间引导杀伤T细胞攻击健康细胞。
“我们通过比较患有NEC的婴儿的大脑和死于其他原因的婴儿的大脑,知道前者有CD4+ T细胞的积累,并显示出增加的微胶质细胞活性,”该研究的资深作者、约翰·霍普金斯儿童中心的首席外科医生、约翰·霍普金斯大学医学院的外科教授大卫·哈克姆说。“我们怀疑这些T细胞来自肠道的nec发炎区域,并开始用新生儿小鼠作为人类婴儿的模型来证明这一点。”
在一系列实验的第一个实验中,研究人员在幼鼠中诱导NEC,然后检查它们的大脑。正如预期的那样,这些组织显示出CD4+ T细胞的显著增加,以及与小胶质细胞活性增加相关的蛋白质的更高水平。在后续测试中,研究人员发现患有NEC的小鼠血脑屏障被削弱了,这是一堵通常可以阻止细菌、病毒和其他在血液中循环的有害物质到达中枢神经系统的生物墙。研究人员推测,这可以解释来自肠道的CD4+ T细胞是如何进入大脑的。
接下来,研究人员确定CD4+ T细胞的积累是NEC脑损伤的原因。他们首先从生物学上阻止辅助T细胞进入大脑,然后在一个单独的实验中,通过将T细胞与一种特殊设计的抗体结合来中和T细胞。在这两种情况下,小胶质细胞的活动都被抑制了,大脑中的白质被保留了下来。
为了进一步确定CD4+ T细胞在脑损伤中的作用,研究人员从患有NEC的小鼠大脑中提取T细胞,并将其注射到同时缺乏T和B淋巴细胞的小鼠大脑中。与没有接受任何T细胞的对照组小鼠相比,接受淋巴细胞的小鼠具有更高水平的吸引杀伤T细胞的化学信号。研究人员还观察到小胶质细胞的激活、大脑的炎症和白质的丢失——这些都是脑损伤的标志。
然后,研究人员试图更好地定义积累的CD4+ T细胞是如何破坏白质的——实际上是一种叫做髓磷脂的脂肪,它覆盖和保护大脑中的神经元,并促进它们之间的交流。为了做到这一点,他们使用了类器官,即在实验室中培养的小鼠脑细胞来模拟整个大脑。来自患有NEC的小鼠的脑源性CD4+ T细胞被添加到这些实验室的“迷你大脑”中,然后进行数周的检查。
Hackam和他的同事们发现,当髓鞘数量减少时,来自T细胞的一种特定的化学信号——一种称为干扰素γ (ifn - γ)的细胞因子(炎症蛋白)——在类器官中增加。在接受来自无NEC小鼠的CD4+ T细胞的类器官中未观察到这种活性。
在类器官中单独添加ifn - γ后,研究人员发现炎症水平增加,髓磷脂减少,与他们在患有NEC的小鼠中看到的相同。当他们添加ifn - γ中和抗体时,细胞因子的产生显著减少,炎症减少,白质部分恢复。
研究人员得出结论,ifn - γ指导了导致nec相关脑损伤的过程。在对患有NEC的小鼠的脑组织进行检查时,他们的发现得到了证实,该组织中ifn - γ的水平高于正常小鼠的组织。
接下来,研究人员调查了CD4+ T细胞是否可以从肠道迁移到患有NEC的小鼠的大脑。为了做到这一点,他们从患有和不患有NEC的幼鼠肠道中获得CD4+ T细胞。这两种类型的细胞被分为两组注射到幼鼠的大脑中——一组可以产生Rag1蛋白质,另一组则不能。缺乏rag1的小鼠没有成熟的T或B淋巴细胞。
接受来自NEC小鼠的肠道源性辅助T细胞的rag1缺陷小鼠显示出与之前实验中看到的相同的脑损伤特征。来自有NEC和没有NEC的小鼠的T细胞都没有引起Rag1小鼠的脑损伤,来自没有NEC的小鼠的T细胞也没有引起Rag1缺陷小鼠的脑损伤。这表明,来自NEC小鼠的肠道来源的辅助T细胞是唯一可以导致脑损伤的细胞。
在第二个试验中,从患有和不患有NEC的小鼠体内提取的T细胞被注射到缺乏rag1的小鼠的腹膜中。只有来自NEC小鼠的肠道T细胞导致了脑损伤。
这一发现通过对患有和不患有NEC的小鼠的脑源性和肠源性T淋巴细胞的相同部分进行基因测序得到了证实。患有NEC的小鼠的辅助T细胞序列平均有25%的基因相似,而没有NEC的小鼠的辅助T细胞序列只有2%的基因相似。
在最后一个实验中,研究人员单独阻断了ifn - γ。这样做为患有严重NEC的小鼠提供了显著的保护,防止其脑损伤的发展。研究人员说,这表明一种治疗方法可能有益于患有这种疾病的早产儿。
“我们的研究强烈表明,帮手T细胞从被NEC感染的肠道迁移到大脑并造成损害,”哈克姆说。“我们研究中的小鼠模型之前被证明与人类的情况非常吻合,所以我们认为这可能是早产儿发生nec相关脑损伤的机制。”
基于这些发现,哈克姆提出了预防这类疾病的措施大脑损伤,包括阻断INF-gamma作用的疗法,可能是可能的。
Diego F. Niño等。坏死性小肠结肠炎引起的认知障碍可以通过抑制小鼠大脑中的小胶质细胞激活来预防,科学转化医学(2018)。DOI: 10.1126 / scitranslmed.aan0237











用户评论