帕金森的疾病风险和严重程度与细胞回收中心的渠道联系在一起
已经发现许多基因突变与一个人发育帕金森病的风险有关。然而,对于大多数这些变体,他们的机制仍然不清楚。
现在是一个新的研究自然由宾夕法尼亚大学的团队领导揭示了两种不同的变化 - 一个增加的变化疾病风险在开发帕金森和另一个减少体内风险清单的人中,导致更严重的疾病。
由Dejian Rer领导的工作,艺术与科学系的教授,展示了变化提高疾病风险,约占17%的人拥有,导致离子的功能减少渠道在称为溶酶体的细胞细胞细胞内,也称为细胞的废物去除和再循环中心。同时,不同的变异,将帕金森病的疾病风险降低了约20%,并以7%的人存在总人口增强相同离子通道的活动。
“我们从基本生物学开始,想要了解这些溶酶体渠道是如何控制的,”仁说。但是,在这里,我们发现这种明确的与帕金森病有关。要了解您可以在离子通道基因中具有变化,可以改变发育帕金森的途径,既越来越多的方式,这是高度的新颖。“
研究人员说明,该频道似乎在帕金森在帕金森发挥至关重要的作用,这也使其成为一种可能减缓疾病进展的药物的潜在目标。
自20世纪30年代以来,科学家已经理解,细胞使用嵌入在其上的仔细受调节的离子通道血浆膜控制其生理学的关键方面,例如在神经元和神经元到肌肉之间穿梭电脉冲。
但直到过去十年来,研究人员开始理解,细胞内具有膜的细胞内,包括内体和溶酶体,也依赖于离子通道进行通信。
“一个原因是难以看待它们,因为细胞器真的很小,”仁说。在过去几年中,他的实验室克服了这一技术挑战,并开始研究这些膜通道并测量穿过它们的离子的电流。
这些离子通过通道蛋白,响应特定因素打开和接近。大约五年前,仁的组鉴定了一种膜蛋白TMEM175,形成允许钾离子进出的通道。
在同一时间,其他球队在做基因组协会研究发现了两种变异的TMEM175,影响了帕金森病的疾病风险,向上或向下转动。
仁说:“一个变异与帕金森在普通人口中的几率增加有关,”。“如果你只看看被诊断出帕金森的人,那种变异的频率甚至更高。”
联系兴趣,仁达到宾夕法尼亚州医师 - 科学家Alice Chen-Plotkin,他与帕金森的患者合作,共同努力。在来自帕金森病患者的数据中,她和同事发现,在携带其中一个TMEM175遗传变异的患者中,电动机和认知障碍更快地进展了REN正在研究的患者。
为了了解这种变异实际上在细胞中做了什么,Ren的实验室将敏锐地对溶酶体敏锐。在分离中,它们发现通过生长因子激活通过TMEM175的钾电流,蛋白质如胰岛素相应的胰岛素,其响应体内营养物质的存在。他们证实,TMEM175似乎是小鼠溶酶体中唯一的活性钾通道。
“当你饿死一个细胞时,这种蛋白质不再是功能,”仁说。“这对我们来说很兴奋,因为这告诉我们这是一个主要机制,可以由细胞器可以使用,以接收来自细胞外部的通信,也许可以向外发送沟通。”
他们发现称为Akt的激酶酶,通常认为通过将称为磷酸盐基团的小分子添加到其作用的任何蛋白质,与TMEM175加入蛋白质通道来达到其末端。但是Akt在不引入磷酸盐组的情况下打开它。“基本酶的教科书指定是它磷酸化蛋白,”仁说。“找到这个激酶作用而不做这是非常令人惊讶的。”
他们接下来转向遗传设计的小鼠以携带相同的变化人口看看遗传变化如何影响动物的离子通道活动。患有疾病风险增长突变的小鼠的钾电流仅为正常小鼠的约50%,并且该电流在没有生长因子的情况下熄灭。相反,小鼠中的离子通道与疾病降低的突变在没有生长因子的情况下持续数小时,甚至比在正常小鼠中所做的更长时间。
“这告诉你这种突变是以某种方式帮助小鼠抵抗营养消耗的影响,”仁说。
为了测量神经元的作用,他们观察到与更严重的帕金森相关的细胞培养中突变的神经元更容易受到毒素和营养耗尽的影响。“如果在人神经元中也是如此,这意味着17%的人口携带变异,可能使其神经元在受到压力源时更损坏,”仁说。
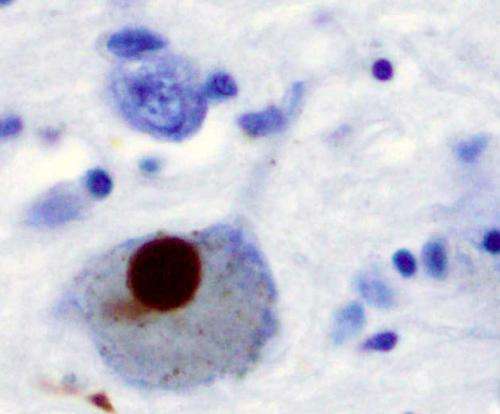
研究人员与Penn研究员合作,调查人员看着细胞培养中神经元中错折叠的蛋白质水平。仁说,在人类身体和帕金森的定义特征和帕金森的特征,这些夹杂物在神经元中增加“惊人”。这可能是由于溶酶体的功能损伤,通常帮助Digeset和Cell产生的废物。
并且,也与人类帕金森有关,缺乏TMEM175的小鼠丧失了一部分产生神经递质多巴胺的神经元,并且在比正常小鼠的协调测试更差。
研究人员与人类的调查结果一起相信他们的工作指出了帕金森病病理的重要贡献者。向前迈进,仁的小组希望深入了解这一点的机制离子通道受到监管。他们的研究不仅可以在帕金森的分子损伤中阐明,而且在其他神经退行性疾病中,特别是与溶酶体有关的分子障碍,其中包括许多罕见但非常严重的条件。
他们也想知道,因为这种易感变异是由如此多的人携带,如果它也影响其他人基因突变有助于某人开发帕金森的可能性。
进一步探索










用户评论