对心脏和神经有毒的蛋白质可能有助于预防老年痴呆症
德克萨斯大学西南分校的一名研究人员领导的一项新研究表明,一种蛋白质在聚集在一起时对神经和心脏造成严重破坏,但它可以防止与阿尔茨海默病相关的有毒蛋白质团块的形成。研究结果发表在最近的生物化学杂志这种脑损伤疾病目前还没有真正有效的治疗方法,也没有治愈方法。
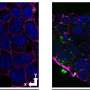
研究人员早就知道粘性斑块的一种蛋白质称为β淀粉样蛋白是阿尔茨海默症的标志,对脑细胞有毒。早在20世纪90年代中期,在这些斑块中也发现了其他蛋白质。
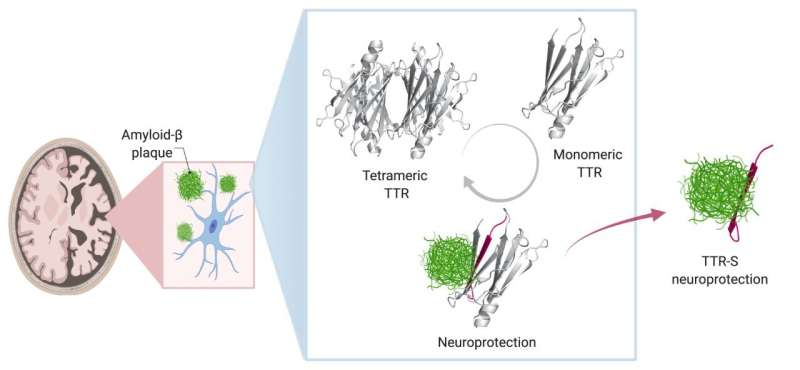
生物物理学助理教授、UTSW阿尔茨海默症和神经退行性疾病研究中心的Lorena Saelices博士解释说,其中一种被称为转甲状腺素(TTR)的蛋白质似乎起着保护作用,该中心是小彼得·奥唐纳大脑研究所的一部分。当以阿尔茨海默氏症为模型的小鼠经过基因改造,产生更多TTR时,它们发展成类似阿尔茨海默氏症的情况的速度更慢;同样,当他们产生更少的TTR时,他们的病情发展得更快。
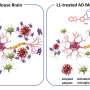
Saelices补充说,在健康的人和动物中,TTR有助于将甲状腺激素和维生素A衍生物视黄醇运输到身体需要它们的地方。在这项工作中,TTR形成了一个四聚体——类似于四叶草的形状,有四个相同的小叶。然而,当它分离成称为单体的分子时,这些单体的作用就像淀粉样蛋白β,在心脏和神经中形成粘稠的纤维,结合在一起形成有毒的团块,导致罕见的淀粉样变疾病。在这种情况下,淀粉样蛋白在器官中积聚并干扰其功能。
Saelices想知道TTR在预防和引起淀粉样蛋白相关疾病方面的不同作用之间是否存在联系。“TTR具有如此相反的功能,这似乎是一个巧合,”她说。“它怎么可能同时具有保护作用和破坏性呢?”
为了探索这个问题,她和她的同事们开发了9种不同的TTR变体,它们具有不同的倾向,可以分离成聚集在一起的单体,形成粘性纤维。有些人做得很快,花了几个小时,而另一些人则很慢。还有一些非常稳定,根本不会解离成单体。
当研究人员将这些TTR变体与β淀粉样蛋白混合并放置在神经元细胞上时,他们发现β淀粉样蛋白的毒性存在显著差异。这些分离成单体并迅速聚集成纤维的变异提供了一些对β淀粉样蛋白的保护,但这种保护是短暂的。那些分离成单体但聚合时间较长的化合物提供了明显较长的保护作用。而那些从未分离的细胞则完全没有抵御β淀粉样蛋白的作用。
Saelices和她的同事怀疑TTR的一部分与β淀粉样蛋白结合,阻止β淀粉样蛋白形成自己的聚集。然而,当这种蛋白质以四聚体形式存在时,TTR的重要部分似乎被隐藏了起来。果然,计算研究表明,当小叶连接时,这种蛋白质的一部分被隐藏起来了,它可以粘附在β淀粉样蛋白上。
然而,这一块往往会粘在自己身上,迅速形成块状。在用化学标签修改了这一块以阻止自我结合后,研究人员创造了肽,可以防止在溶液中形成有毒的β淀粉样蛋白团块,甚至可以打破预先形成的β淀粉样蛋白斑块。修饰的TTR多肽与β淀粉样蛋白的相互作用导致转化为一种被称为无定形聚集体的形式,很容易被酶分解。此外,经过修饰的肽可以防止淀粉样蛋白“播种”,在这个过程中,从阿尔茨海默病患者身上提取的β淀粉样蛋白原纤维可以作为新原纤维形成的模板。
Saelices和她的同事们目前正在小鼠模型中测试这种改良的TTR肽是否可以预防或减缓阿尔茨海默症的进展。如果他们成功了,她说蛋白质Snippet可以成为治疗这种顽固性疾病的新疗法的基础。
“通过解开TTR的双重作用之谜,”她说,“我们或许能给阿尔茨海默症患者带来希望。”











用户评论