研究人员识别新的靶标,可以提高胰腺癌的汽车T细胞治疗安全性
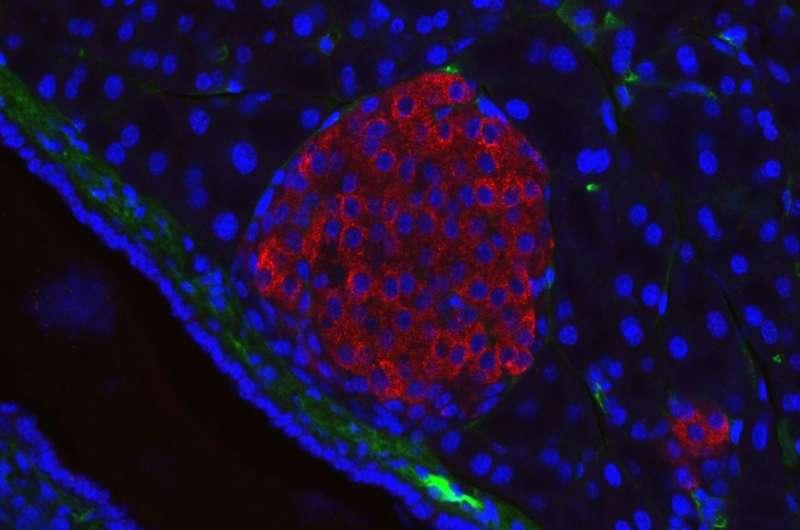
来自伦敦玛丽女王大学的研究人员发现了一种蛋白质,它可能是胰腺癌治疗的新靶点。利用这种蛋白质作为目标,该团队成功地创造了CAR - T细胞疗法——一种免疫疗法——在临床前模型中杀死胰腺癌细胞。
Car T细胞疗法是一种免疫疗法,对某些血液癌的治疗表现出了很大的希望;然而,使用这种治疗的固体肿瘤的治疗已经证明非常困难。成功的一个障碍是癌症以外的组织中的毒性,因为目前用于瞄准汽车的大多数蛋白质细胞对于胰腺癌细胞和其他实体瘤的含量在其他正常组织上存在低水平,导致有毒副作用。
在本研究中,今天发布临床癌症研究在英国慈善机构胰腺癌的资助下,该团队发现了一个蛋白质称为CEACAM7,可以代表对胰腺导管腺癌(PDAC)的疗法发展的更安全的处理目标,是最常见的胰腺癌。
通过使用称为免疫染色的专业技术,该团队研究了人类PDAC样品的面板,以及用于CEACAM7的存在的正常组织。测试的CEACAM7测试的PDAC样品的大量子集,但蛋白质在包括扁桃体,肺,肝脏和前列腺的正常组织面板中,表明CEACAM7可能是胰腺癌COLT细胞发育的理想目标。
为了确定CEACAM7作为治疗目标的潜力,该团队开发了靶向CEACAM7的汽车T细胞,并将其应用于PDAC细胞系以及PDAC的临床前模型。汽车T细胞有效地靶向PDAC细胞培养物中的CEACAM7表达细胞,并在PDAC的后期临床前模型中消除了癌细胞。
来自伦敦王后大学的John Marshall教授领导了这项研究,说:“这是一个令人兴奋的发展。发现CeAcam7允许我们特别用Car T细胞杀死胰腺癌细胞,同时在非肿瘤组织中没有显着毒性,给予美国希望将来可能会有效。也可以将其他类型的免疫疗法引导至CeacaM7以用于治疗胰腺癌。“
博士后研究员Deepak Raj博士是这项研究的第一作者,他说:“由于CEACAM7目前还没有得到很好的研究,我们很高兴地发现它似乎是一个很有前途的CAR - t细胞靶向胰腺癌的靶点。评估大量针对CEACAM7的抗体是很重要的,这不仅是为了产生和测试更大规模的CAR - T细胞,以提高对胰腺癌的疗效,而且更有决定性的规则是否在正常组织中存在低水平的CEACAM7。”
汽车T细胞疗法如何工作?
汽车T细胞疗法使用免疫细胞(称为杀手T细胞)从患者的血液中具有关键作用在免疫反应中具有关键作用。杀手T细胞首先从患者的血液中分离,并在实验室中修饰,以表达其表面上的特殊蛋白质受体,称为嵌合抗原受体(汽车),产生汽车T细胞。汽车蛋白质允许汽车T细胞识别癌细胞表面上的特定蛋白质。在实验室中乘以CAR T细胞,然后重新注射回患者,在那里他们识别并杀死其表面上具有靶蛋白的癌细胞。
在这项研究中,团队使用来自合作仪教授Brad Nelson(不列颠哥伦比亚省,加拿大)的Ceacam7的一部分抗体的一部分新车。然后,它们改性杀手T细胞在其表面上呈现这种新的轿车蛋白质,以识别和结合CeAcam7,将杀手T细胞引导只用CeAcaM7杀死细胞,这些似乎只是胰腺癌细胞。
治疗胰腺癌的挑战
胰腺导管腺癌(PDAC)是最常见的胰腺癌类型,并且所有常见癌症的存活率最低,只有约7%的人在英国诊断出这种癌症类型的人生存5年或更长时间。由于缺乏明确的症状,诊断往往为时已晚,从中手术去除肿瘤 - 这提供了最大的机会 - 是不可能的。新的和更有效的有针对性的疗法迫切需要。
Chris Metdonald,胰腺癌英国的研究负责人表示:“这些发现非常令人鼓舞,提供真正的希望,即胰腺癌的新,创新的免疫疗法治疗在地平线上。对于胰腺癌的第一次明确和特异的靶蛋白已经确定了细胞,并且令人遗憾的是,Barts的辉煌团队表明,通过专注于它,它们可以破坏癌症而不会损害健康组织。这从未在胰腺癌中进行过,朝着绝望需要的新阶段迈出了重要的一步治疗选项,这既均为更有效,对患者的副作用较少。
目前治疗方案有限,受到这种破坏性疾病影响的人面临的生存率令人难以置信的低。我期待在未来的临床试验中看到靶向该蛋白质的结果。我希望我们希望看到这些调查结果,以及由胰腺癌英国的大挑战资助的其他研究,使我们看到新的免疫治疗治疗的方式有益于其他类型的人癌症”。
进一步探索










用户评论