2021年1月25日功能
肿瘤细胞揭示了核心的核心平移,以逃避宿主防御
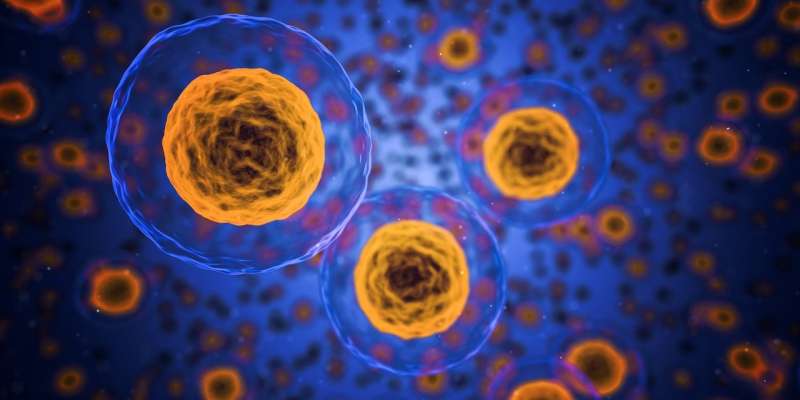
毒素,辐射和正常代谢过程在一起在每种细胞中产生分子病变,每天曲调10,000至1,000,000次击中。幸运的是,大多数这些代码故障都会通过复杂的DNA修复机制立即修补。对肿瘤抑制剂或其他关键代谢基因的任何未检测到的损伤通常会导致这种搅拌凋亡循环被触发,并且细胞优雅地从游戏中鞠躬。如果和当发生故障时,细胞将从任何突变的蛋白质向免疫系统呈现抗原,以便在它可以去流氓之前可以消除它。
但事情不会结束那里。癌症细胞将继续重新洗牌,并最终,他们将逃脱或以其他方式灭活免疫细胞提出了反对他们。当肿瘤经历第一轮化疗时,它们已经是欺骗的高手了。最坏的情况是,当被击倒时,他们会不知何故找到一种方法来阻止、解毒或排出任何挑战他们的药物。考虑到肿瘤细胞从一个或多个初始克隆的速度发展,无法进入其他复杂,不断发展的系统使用的全套性或其他重组工具,它们如何剥离这种分子熟练素的这种壮举?
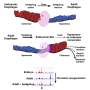
佛罗里达州坦帕市莫菲特癌症中心的Daria Miroshnychenko等人最近提供了一个答案:肿瘤细胞相互结合,分裂卡片,然后经历它们自己独特的小型进化。这一过程包括一种粗略的重组和核型还原,直到出现一些可行的,但可能是异质的后代。作者认为,肿瘤所做的实际上是一种准性进化形式,类似于真菌、酵母或其他单细胞生物中所见的。副性周期提供体细胞变异,而没有完全的减数分裂和专用的生殖细胞。
以前,肿瘤细胞被认为是严格无性的。换句话说,他们发现的任何新的遗传和表观遗传液都将是克隆的,因此仅通过直接后代遗传。然而,频繁观察癌细胞融合在一起普通细胞和其他的癌细胞,已经变得难以忽视。对于一个被锁定的癌细胞来说,与一个有特殊运动倾向的正常细胞融合可能是一条出路。融合过程本身,特别是在某些病毒的刺激下,甚至可能是致瘤事件的基础。在一些脑瘤中,如胶质母细胞瘤,已经证明灌注形成一个大的、相互连接的合胞体对它们抵抗化疗的生存至关重要。这似乎是因为这个网络可以很容易地重新分配线粒体,给特定区域额外的能量储备和抵抗力。身体中的其他细胞,如肌肉细胞、破骨细胞和胎盘细胞,通常会融合成合胞体,以实现它们生命中特定的代谢目标。
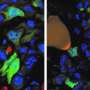
核聚变事件到底有多普遍?研究人员通过观察三阴性乳腺腺癌细胞系来解决这个问题。这些细胞缺乏雌激素、孕激素和Her2受体,因此具有很强的侵袭性,很难治疗。通过用绿色的GFP结构物标记其中的一半,用mCherry红结构物标记其中的一半,他们可以用FACS荧光细胞分选的流式细胞术来计数被这两种结构物标记的细胞。利用延时视频技术,他们还可以了解有多少双标记细胞真正融合,以及有多少由于胞质和细胞器通过外泌体的偶然交换或从瞬态纳米管丝直接转移而出现假阳性。研究人员使用了原位肿瘤模型,这意味着细胞被移植到正常的起源器官(原位移植),允许与周围的细胞和基质相互作用。
他们还看着其他肿瘤系列,包括SUM159PT细胞和MCF-7细胞。前者具有较弱的肺部定植潜力。后一种细胞更代表具有表达雌激素受体的许多常见且较少的侵袭性肿瘤。如果将它们植入皮下脂肪或乳腺脂肪垫中,这些细胞仅在雌激素补充的小鼠中致瘤。如果没有雌激素,如果植入有介导的话,它们可以是致瘤的。
在其他最近的研究,具有乳腺癌细胞的间充质基质细胞的细胞融合,显示出形成至少四种新的和完全独特的杂化克隆。研究人员使用实验性疾病,表明每个品种都有自己的干性和上皮到间充质转换的潜力。这些细胞融合在肿瘤中的效果的全部仍有待观察。其他研究人员已经发现患者患有骨髓移植治疗胰腺导管腺癌的患者中的融合杂交。众所周知,由于发现来自移植患者的黑素瘤细胞具有来自供体和受体的等位基因,因此这些融合可以转移。
在近期科学历史悠久的历史上,已经记录了更多的异国情调融合的奇异示例。发现一个女人在她的脑细胞中有Y染色体,显然来自胎儿细胞,该细胞被设法穿过胎盘屏障进入她的血液,同时怀孕时孕育了她的发展儿子。然后,这些细胞被证明是足够的灵活性,以通过神经元越过血脑屏障和熔丝。细胞可以如此容易地适应细胞类型的非正规并置的事实,并且以某种方式在几乎正常 - 或至少可生存的核型中呈现在从后果中的结合,这表明这种现象可能比以前想象更广泛地普及。
在来自有丝分裂的MeIosis衍生中性别起源的一个更有趣的假设中,进化生物学家威廉马丁建议多核合胞常见常见真核祖先。在他的观点中,这种环境是细菌衍生的原始挑选的理想环境,以在其古代宿主内获得立足点。只有那么宿主只有足够的精力充沛的资源,可以为适当的染色体分离所需的管蛋白长丝的真正森林进行聚合。因此,真核生物的起源是垂直谱系遗传的起源,并且需要性行为来保持垂直演化的谱系,通过拯救从常俗称为穆勒的棘轮的缺陷的缺陷的缺陷的真核血管来保持垂直演化的血缘。
鉴于这些精致的考虑因素,未来的所有形式的乳腺癌都会丧失所有形式的乳腺癌都会涉及采取这些新的融合和体细胞进化能力癌症细胞考虑到。细胞融合的离散抑制剂,如果发现存在,可能是一个可能的新途径来调查。
进一步探索
Sriram G. Garg等人。线粒体,细胞周期,以及通过合胞真核生物共同祖先的性起源,基因组生物学与进化(2016)。DOI:10.1093 / GBE / EVW136
©2021科学BOB体育赌博X网络











用户评论