研究强调了慢性感染期间出现新SARS-CoV-2突变的风险
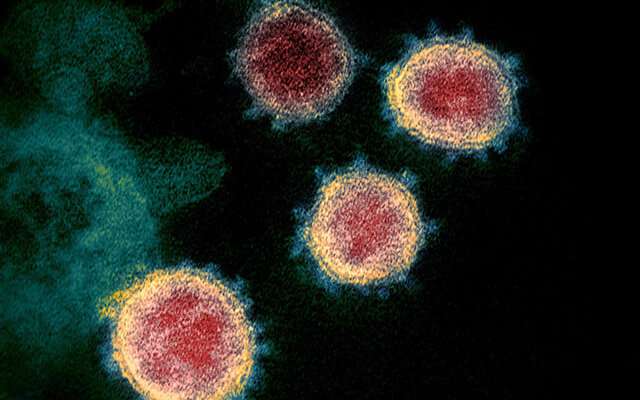
科学家说,在慢性感染病例中,可能会出现类似于B1.1.7 UK变体的SARS-CoV-2突变,长期治疗可以为病毒提供多次进化机会。
写在自然由剑桥大学研究人员领导的一个团队报告了他们如何能够在一名接受康复血浆治疗的免疫功能低下患者身上观察到SARS-CoV-2突变。特别是,他们发现了一种关键突变的出现,这种突变也出现在新变体中,导致英国再次被迫进入严格的封锁状态,尽管没有迹象表明这种变体源于这位患者。
使用合成版的病毒在实验室中产生的刺突蛋白,研究小组证明了其遗传密码的特定变化-在B1.1.7变异中看到的突变-使病毒对细胞的传染性是更常见的毒株的两倍。
导致COVID-19的SARS-CoV-2病毒是一种乙型冠状病毒。其RNA-its遗传密码-由一系列核苷酸组成(化学结构由字母a、C、G和U表示)。当病毒自我复制时,这段代码可能会被错误转录,导致错误,即突变。冠状病毒的突变率相对适中,每年约有23个核苷酸替换。
特别值得关注的是可能改变“刺突蛋白”结构的突变,这种蛋白质位于病毒表面,使病毒具有特有的冠状形状。这种病毒利用这种蛋白质附着在宿主细胞表面的ACE2受体上,允许它进入细胞,在那里它劫持了它们的机制,允许它在全身复制和传播。目前大多数正在使用或正在试验的疫苗都以刺突蛋白为目标,人们担心突变可能会影响这些疫苗的效力。
剑桥大学领导的英国COVID-19基因组学联盟(COG-UK)的英国研究人员发现了该病毒的一种特殊变体,其中包括似乎使其更具传染性的重要变化:刺突蛋白部分的ΔH69/ΔV70氨基酸缺失是该变体的关键变化之一。
尽管ΔH69/ΔV70的缺失已经被检测到多次,但直到现在,科学家们还没有看到它们出现在个体中。然而,今天发表在自然剑桥大学的研究人员记录了这些突变是如何出现在阿登布鲁克医院的一名COVID-19患者身上的,该医院是剑桥大学医院NHS基金会信托基金的一部分。
有关的个人是一个70多岁的男人,他之前被诊断患有边缘B细胞淋巴瘤,最近接受了化疗,这意味着他的免疫系统被严重破坏了。入院后,患者接受了一系列治疗,包括抗病毒药物瑞德西韦(remdesivir)和恢复期血浆(即从成功清除病毒的患者血液中提取的含有抗体的血浆)。尽管他的病情最初稳定,但后来开始恶化。他被送入重症监护室接受进一步治疗,但后来死亡。
在患者住院期间,有23个病毒样本可供分析,其中大部分来自他的鼻子和喉咙。这些测序是COG-UK的一部分。研究人员正是在这些序列中观察到病毒的基因组突变。
在第66天和82天之间,在前两次给予恢复期血清后,研究小组观察到病毒种群发生了戏剧性的变化,一种带有ΔH69/ΔV70缺失的变体,以及一种被称为D796H的刺突蛋白突变,成为主导。虽然这种变异最初似乎消失了,但当第三个疗程的瑞德西韦和恢复期血浆治疗被施用时,它又重新出现。
领导这项研究的剑桥治疗免疫与传染病研究所的拉维·古普塔教授说:“我们看到的本质上是病毒不同变体之间的竞争,我们认为这是由恢复期血浆疗法驱动的。”
“最终获胜的病毒-具有D796H突变和ΔH69/ΔV70缺失-最初在恢复期血浆治疗中占据上风,然后被其他菌株超越,但在治疗恢复时重新出现。其中一个突变是在新的英国变体中,尽管没有迹象表明我们的患者是它们最初出现的地方。”
在严格控制的条件下,研究人员创造并测试了一个合成版本的病毒,其中ΔH69/ΔV70缺失和D796H突变单独和一起。结合突变使病毒不那么敏感的中和康复的等离子体尽管D796H突变似乎是导致血浆中抗体敏感性降低的唯一原因。仅D796H突变就会导致在没有血浆的情况下失去感染,这是病毒为了逃避免疫压力而获得的典型突变。
研究人员发现,仅删除ΔH69/ΔV70基因就会使病毒的传染性增加一倍。研究人员认为,这种缺失的作用是为了弥补D796H突变导致的传染性丧失。这种模式对于病毒来说是典型的,即逃逸突变紧随或伴随代偿突变.
古普塔教授补充说:“鉴于疫苗和治疗方法都是针对刺突蛋白的,我们在患者身上看到了这种蛋白质的突变,我们的研究提出了一种令人担忧的可能性,即病毒可能会发生突变,以战胜我们的疫苗。”
“这种影响不太可能发生在免疫系统正常的患者身上,因为免疫控制更好,病毒多样性可能更低。但它强调了我们在治疗免疫功能受损患者时需要注意的问题,在这种情况下,病毒复制时间可能会延长,给病毒变异提供了更大的机会。”














用户评论