免疫系统为SARS-CoV-2铺平了道路如何
大多数人感染SARS-CoV-2能够从疾病中恢复回来如果他们可能经验很有压力疾病进展。有些人没有任何症状。但是大约百分之十的患者变得如此重病,他们必须在医院接受治疗。一个假设,即弱免疫系统严重恶化的背后是目光短浅。尤其是关键进展,免疫系统工作压力,但不设法控制病毒。
柏林SARS-CoV-2如何使用一个研究小组已经观测到免疫系统防御机制越来越劫持人体粘膜细胞和繁殖。他们的研究刚刚出现在杂志上EMBO分子医学。“这可能给我们部分解释为什么免疫系统调节困难,甚至击败了一些人的感染,”朱利安Heuberger博士说,科学家在肝脏病学与胃肠病学柏林夏洛——夏洛蒂的医疗部门。他是这项研究的第一作者,艾美奖Noether成员Michael Sigal PD博士领导的研究小组在柏林夏洛和医学系统生物学研究所(BIMSB)、马克斯·德尔布吕克的一部分分子医学中心的亥姆霍兹联合会(MDC)。在这项研究中,研究小组与马克斯普朗克研究所的研究人员合作感染生物学(MPIIB),柏林自由大学和香港大学。
SARS-CoV-2使用防御机制作为入境口岸
实际上,人体有一个非常有效的抵御入侵的防御机制,基于各种免疫细胞的相互作用。T细胞发挥重要作用:当他们遇到病毒的生物,破坏细胞的影响。他们还会分泌信号分子移行细胞(IFN-γ)。一方面,IFN-γ战斗传染性病原体。另一方面,它调用其他免疫细胞。
Heuberger和他的同事们已经表明SARS-CoV-2可以把这种保护机制由IFN-γ变成它的反面。为除了免疫细胞,身体的粘膜细胞也应对IFN-γ形成更多ACE2受体。SARS-CoV-2需要这些ACE2受体作为一个港口进入细胞。反过来,感染细胞更ACE2。这样,IFN-γ响应的上皮细胞和病毒本身加强SARS-CoV-2感染。
在结肠瀑样细胞分化的观察
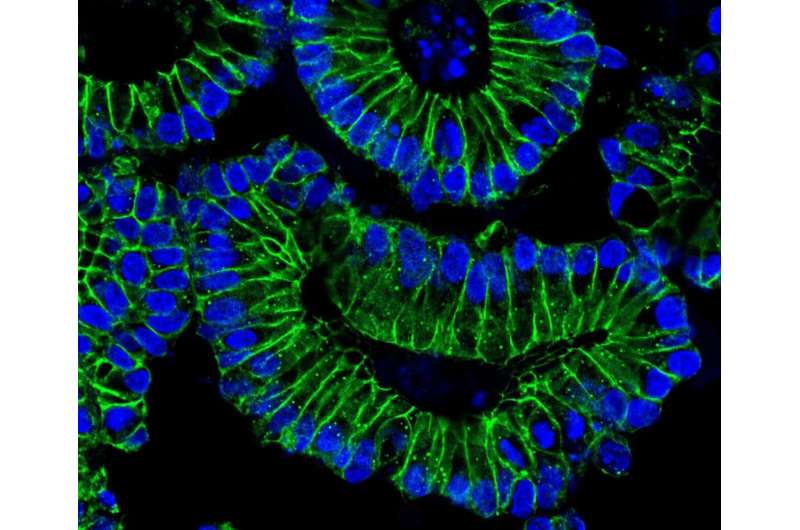
患者感染SARS-CoV-2有时显示胃肠道症状。为了观察肠细胞免疫级联,Heuberger培养瀑样的人类结肠。一个瀑样是一种mini-organ培养皿中,几乎没有一个针头大小的。结肠瀑样是基于细胞来自肠活检。他们生长在三维的安排单位和复制的生理学在人类肠道粘膜细胞。“这些结肠瀑样是一个非常有用的工具,”Heuberger强调。“我们可以使用它们来探索不同信号通路的复杂的相互作用,控制细胞分化干细胞特殊的上皮细胞。
科学家们第一次培养肠道细胞治疗IFN-γ模拟人体的免疫反应。然后,他们感染与SARS-CoV-2瀑样。使用基因表达分析和激光扫描microscope-a特殊的光学显微镜,扫描样本点的时候他们能够衡量增加ACE2表达瀑样。此外,定量聚合酶链反应(PCR)检测到病毒增加生产。
换句话说,IFN-γ越多ACE2。ACE2越多病毒可以进入细胞。病毒进入细胞越多,更多的病毒。因此,免疫反应和细胞表面反应为SARS-CoV-2感染铺平了道路。
平衡过度IFN-γ反应和药物
“我们假设一个强大的免疫反应可能增加黏膜细胞的敏感性SARS-CoV-2,”这项研究的负责人说,迈克尔Sigal博士。他指导胃肠障碍,再生和致癌作用的实验室在查利特和民运以及胃肠病学家查利特。从一开始就“如果IFN-γ浓度较高或感染引发的过度生产IFN-y,病毒可能更容易进入细胞”。然而,这实际上发生的条件仍然必须进行临床试验。
研究结果进行的治疗方法对严重COVID-19课程,Heuberger认为:“一个可能的策略可以用药物来平衡IFN-γ响应。”However, this would first require a very detailed analysis of the mechanisms underlying the IFN-γ response.
进一步探索








用户评论