对可以治疗亨廷顿舞蹈病的蛋白质结构的新见解
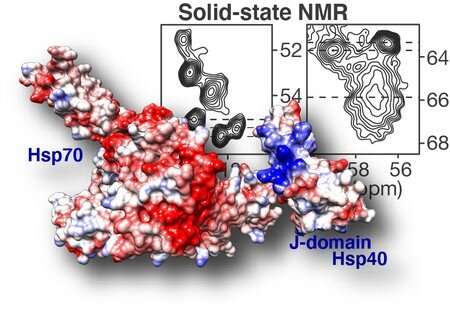
在亨廷顿舞蹈症中,一种有缺陷的蛋白质聚集在脑细胞中,最终杀死它们。原则上,热休克蛋白可以防止这种蛋白质聚集。然而,目前还不清楚这些蛋白质如何与亨廷顿舞蹈症蛋白相互作用。Patrick van der Wel(荷兰格罗宁根大学)和德克萨斯大学的同事们的新研究部分地解决了与这种聚集蛋白结合的热休克蛋白的结构,帮助我们理解它们是如何工作的。该研究结果于2月11日发表在该杂志上自然通讯.
热休克蛋白(Hsp)是由暴露在压力条件下的细胞产生的。热休克蛋白家族是多种多样的,有相当一部分蛋白具有伴侣蛋白的功能。这意味着它们帮助其他蛋白质以正确的方式折叠(或在受损后重新折叠)。“这些蛋白质可以帮助折叠数千种不同的蛋白质。为此,他们使用具有特定结合能力的联合伴侣,”格罗宁根大学固体核磁共振光谱副教授Patrick van der Wel解释道。
命令
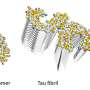
一类热休克蛋白Hsp40有助于抑制像亨廷顿舞蹈症中出现的那种蛋白质聚集。这些Hsp40蛋白有不同的种类,其中一些会特异性地与含有大量重复谷氨酰胺氨基酸的聚集蛋白结合,就像在亨廷顿舞蹈症中发现的缺陷蛋白一样。其中一种Hsp40蛋白质被称为DnaJB8,这是Van der Wel和他的同事研究的蛋白质。
“为了理解DnaJB8的作用,我们需要知道它是什么样子的,”Van der Wel说。然而,这类蛋白质的结构很难解析。他继续说:“它以二聚体或寡聚体的形式出现,所以这些蛋白质单位一起工作,但它们的结构并不是真正有序的。”这使得不可能使用标准的技术,因为这些技术都需要有序的结构。
碳原子
德克萨斯大学(University of Texas)的同事请范德维尔(Van der Wel)帮忙解决这个问题。范德维尔是固态核磁共振波谱学的专家,这种技术可以测量原子之间的连接方式。简单来说,DnaJB8中两个相连碳原子的核磁共振信号取决于它们如何与分子中的其他原子相互作用。因此,碳原子的测量光谱可以显示它们位于哪个氨基酸中。这些信息可以用来了解蛋白质的结构,即使它不是很有序。
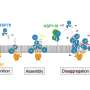
DnaJB8蛋白是由不同的领域,具有不同的功能。通过一系列实验,Van der Wel能够确定哪些结构域被卡在DnaJB8蛋白内部,哪些结构域在外部。实验表明,DnaJB8所谓的“J域”能够在被卡住和可访问之间切换。这很重要,因为DnaJB8蛋白的这一部分负责打开Hsp70蛋白,这可以阻止蛋白质聚集物的形成。换句话说,DnaJB8中似乎有一个“开关”,控制着这种与Hsp70的相互作用。有趣的是,这个开关被发现位于DnaJB8的一个域,而这个域的确切作用之前还不清楚。
假设
“因此,我们基于结构的假设是DnaJB8在与有缺陷的蛋白质结合之前是不活跃的,然后它会吸引Hsp70,”Van der Wel说。德克萨斯大学的一系列模拟和实验证实了这一想法,并得出了这些蛋白质如何协同工作的详细模型。
DnaJB8是一种主要存在于睾丸中的蛋白质。然而,一种非常相似的蛋白质DnaJB6存在于亨廷顿舞蹈症发作的大脑中。这种蛋白质的作用似乎很相似,它可以保护患者脑细胞中聚集的富含谷氨酰胺的蛋白质。“这可能需要许多年的时间,但现在我们了解了这个过程是如何工作的,它可以帮助我们找到一种增强DnaJB6活性的方法,这可以减少癌症蛋白质聚集导致疾病,”Van der Wel总结道。
进一步探索






用户评论