研究发现参与免疫反应和脓毒症的非编码RNA
当身体对感染的免疫反应失控时,结果可以是败血症,一种危及生命的炎症性能,其中压倒性的炎症反应可以迅速导致多种器官和死亡。
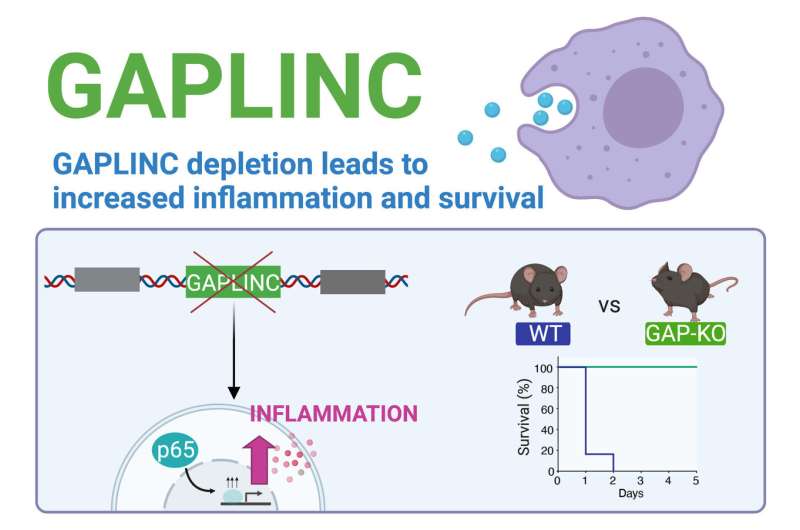
在一项新的研究中,UC Santa Cruz的研究人员已经确定了一种长的非分量RNA(LNCRNA)分子,该分子调节促炎基因的表达免疫系统细胞称为巨噬细胞并影响小鼠的易感性腐败。
此前,这种称为Gaplinc的LNCrNA以其在癌症中的作用中研究,但事实证明是巨噬细胞中最表达的LNCRNA,这在炎症中起着核心作用。苏珊木匠,UC Santa Cruz的分子,细胞和发育生物学助理教授表示,当她的实验室表现了人类巨噬细胞的RNA测序和它们的前体,白血细胞单核细胞。
随后的实验表明,减少或消除GAPLINC可增强小鼠和人类炎症基因的表达细胞。矛盾的是,这种效应在败血症小鼠模型中受到内毒性休克和死亡的保护小鼠。差异是显着的,所有正常(“野生型”)小鼠在一天内死亡,而Gaplinc的所有小鼠都被淘汰。
“我们的假设是,淘汰赛小鼠在内毒素休克模型中会更糟糕,所以我们惊讶地发现他们做得更好,”Carpenter,关于新发现的一篇论文的同伴发表于2月1日国家科学院的诉讼程序。
非编码RNA是指从基因组转录而不翻译成蛋白质的RNA分子,而lncRNA是最大的一类非编码RNA。近年来,科学家在哺乳动物基因组中发现了数千个lncrna,它们在不同的生物学过程中调节基因表达。GAPLINC是在人类和小鼠中同时发现的lncRNA的少数例子之一。
该论文的第一作者、卡彭特实验室的研究生Apple Vollmers说,该团队的RNA测序结果显示,在单核细胞分化为巨噬细胞期间,GAPLINC高表达。
沃尔默斯说:“我们最初认为它与调节分化有关,但当我们耗尽它时,就打开了炎症基因。”“这是一种低水平的表达,所以当巨噬细胞对病原体作出反应时,基因启动的水平不同。”
败血症的小鼠模型涉及将小鼠暴露于称为脂多糖(LPS,也称为内毒素)的革兰氏阴性细菌的组分,这已知是引发细菌感染中的脓毒性冲击。木匠从炎症基因表达的低基线水平开始,炎症性可能使炎症反应LPS对系统的冲击。“而不是从零到100,你可能会从10到100开始,我们认为提供了一些保护,但我们不确定为什么,”她说。
巨噬细胞是体内对任何受伤或感染的第一个细胞中涉及的第一个细胞。他们是巡逻员和第一个受访者,在血液中循环作为单核细胞并分化为巨噬细胞,转向所需的网站,以帮助对抗感染或治愈伤害。
“他们有助于打开炎症,但它们也在转向时发挥重要作用,”木匠说。
当单核细胞分化为巨噬细胞时,Gaplinc的表达导通,并且在细胞暴露于LPS后,它被拒绝。“这些步骤之间发生了有趣的事情,在某种程度上调制Gaplinc的表达可能是保护的,”木匠说。
在败血症中,随着细胞释放出一种叫做细胞因子的炎症蛋白洪水,炎症反应进入过载。细胞因子通常在梯级中产生,因为一种细胞因子刺激其靶细胞制作额外的细胞因子。不受控制的细胞因子产生通常称为“细胞因子风暴”。该过程还触发凝血,然后血凝块抑制血管血液的流量,导致器官衰竭和死亡。Sepsis也可以被病毒感染引发,并且可能参与Covid-19的严重案例。
“败血症的最大问题是它发生得如此之快,一旦它进入就没有良好的治疗选择,”木匠说。
更好地了解Gapl处在控制炎症反应和脓毒症休克中的作用可能导致药物开发的新机会靶向败血症。
“我们从理解你如何治疗这种治疗情况,但至少我们已经确定了一个途径,”木匠说。
进一步探索














用户评论