AAV递送基因疗法的新视野
近年来,腺相关病毒(AAV)被认可为用于治疗基因的体内递送的前载体(载体),因为它是非致病性的并且有效地靶向许多不同的细胞和组织类型。最近的联邦药物管理局(FDA)对治疗脊髓肌肉萎缩的基于AAV的基因替代疗法和遗传性视网膜营养不良的形式突出了这种治疗方式的承诺。
体内基因疗法的关键挑战是它们导致的潜力免疫反应和炎症,这可能会影响治疗或持续的疗法程度,并且在罕见的情况下甚至可以危及生命。最近报告的三个儿童的死亡是在试验治疗X-Libented肌瘤肌病的试验中获得高剂量的儿童的死亡急剧介绍了αav介导的毒性和免疫应答,并且目前的AAV送货车仍然需要进一步改善。
AAV衣壳和基因组都可以作为免疫原性成分。具体来说,包含治疗基因的载体基因组可以激活一种称为toll样受体9 (TLR9)的蛋白质,这是一种所谓的模式识别受体,它可以特异地感知外来DNA免疫细胞。这首感觉首先触发了一个免疫反应这导致炎症(先天免疫),随后更具体的免疫应答(以细胞毒性T细胞形式的适应性免疫)对抗AAV衣壳,防止治疗生效并造成潜在风险。
现在,在基因治疗和视觉科学中的国际合作,包括乔治教堂在哈佛大学的生物学启发工程和哈佛医学院(HMS)和康斯坦茨·彼得科的HMS康斯坦特·贝科霍集团,制定了“耦合免疫调节”战略短TLR9-抑制序列直接掺入含有治疗性DNA序列的更长的AAV基因组中。研究在小鼠的不同组织中,以及猪和非人类原始的眼部组织,该方法显示出广泛的抗免疫原性潜力。重要的是,该研究还突出了除TLR9激活以外的途径可能在猕猴中玻璃体内AAV注射液中高度免疫原模型中有助于炎症。这项工作发表在科学翻译医学。
该项目于Wyss Institute和HMS在乔治教堂的集团启动。教堂,博士,是Wyss Institute的核心教师,并领导了该研究所的合成生物学平台。他还在哈佛医学院和哈佛大学和马萨诸塞州技术研究院(麻省理工学院)的遗传学教授。
使用偶联免疫调节覆盖AAV
“我们假设染色和抑制TLR9活化的DNA的小片段,包括来自称为端粒的人染色体的末端的DNA序列,将是从这种免疫监测机制中剥夺AAV基因组的方式,当直接进入其中时,”说第一和与合作作者英凯陈,博士,以前是与盟友治疗学的教会和首席科学官员一起工作,目前在Wyss的访问学者。陈和教堂都是Wyss基因治疗启动公司盟友治疗的共同创始人。
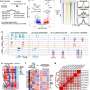
该团队通过产生一系列合成DNA“炎症抑制寡核苷酸”(IO)序列,其每种携带与不同TLR9抑制序列之一连接的高炎症部分,并测试其对培养细胞的影响。TLR9抑制序列的存在抑制了炎症反应达95%。当作为串联系列直接结合到AAV载体中时,与未改性的载体相比,IOS抑制原发性人免疫细胞中的先天免疫应答
为了测试AAV在体内的策略,研究人员将AAV作为全身治疗或局部地施入小鼠的肌肉组织。对照病毒缺乏IO序列诱导的抗病毒干扰素反应和肝脏中先天免疫细胞的浸润,并导致肌肉组织中细胞毒性T细胞的渗透和激活。在缺乏功能性TLR9途径的突变小鼠中不存在这些效果,表明TLR9确实是AAV诱导的炎症的关键调节因子。重要的是,在接受其基因组中含有IO序列的小鼠的小鼠中堵塞或减少了效果,以及偶联的免疫调节策略增强了病毒所递送的转基因的表达,这表明潜在的疗效较高。
调查眼睛中的偶联免疫调节
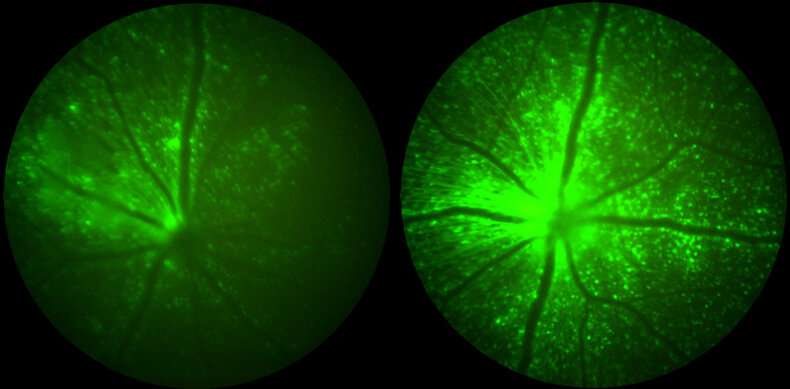
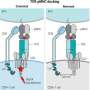
眼睛通常被描述为免疫特异性位点,因为存在血尿视网膜屏障,其限制免疫细胞的进入和免疫抑制因子。然而,多种临床试验报告了在治疗相关剂量AAV的眼睛中,展示了对免疫特权的限制。眼睛中的大多数基于AAV的基因疗法直接施加到视网膜(Subortinal注射)上。AAV输送到玻璃体腔(玻璃体内注射)的眼睛是非常理想的,因为它会较少侵入性并且可能允许靶向更多细胞,但遗憾的是很高的炎症。
使用体内成像和免疫细胞表征技术在玻璃体注射小鼠中的AAV病毒后,该团队证明,与未修饰的AAV相比,在病毒基因组中掺入IO序列降低了眼睛中浸润的T细胞群的炎症和数量。这进一步与视网膜中的载体编码的报告基因表达的多变升压相互作用。
接下来,该团队在大型动物模型中研究了他们的耦合免疫调节策略,首先通过Subretinal注射猪,然后在猕猴中通过玻璃体肌醇注射。“我们发现,这种策略改善了猪中的AAV病毒引发的明显病理,包括缩短了对高敏锐性愿景所必需的光感受器细胞,”陈王某表示,他作为捷克群组的医学生。他们还发现通过免疫细胞的视网膜的感光层渗透,包括微胶质细胞和T.细胞,基本上救出。
“在通过玻璃体内注射接受设计和控制AAV的MAAQUES中,这些免疫抑制作用不幸的是不是发音,尽管我们看到偶联的免疫调节方法延迟了对照病毒引发的临床葡萄膜炎症状,并且允许两倍的表达增加治疗基因,“王说。此外,使用预防性全身免疫抑制不能防止观察到的葡萄膜炎,表明该途径的免疫原性挑战更复杂。
“由AAV诱导的玻璃体外毒性的结果以及对TLR9阻断序列和类固醇的适度反应,表明存在具有来自该注射部位的毒性的一种以上的机制。我们现在可以通过这种理解和搜索来进行毒性对于额外的途径,“Cepko,Ph.D.,HMS的Blavatnik学院的遗传学和神经科学教授,以及霍华德休斯医学院和哈佛干细胞研究所成员的调查员。
“在临床中实现初始成功的每种新的治疗方式都必须在广泛部署之前与新出现的问题进行擒抱,AAV基因治疗也不例外。我们的工作代表了下一代更安全的AAV车辆的重要一步陈说,更有效“
“这一重要的Wyss-在综合生物学,视觉科学和基因治疗方面的领先专家之间的合作在AAV工程中开辟了新的方向,最终通过有针对性的病毒基因组工程使基因治疗更安全,更有效,”Wyss创始唐纳德Ingber, M.D., Ph.D., who is also the Judah Folkman Professor of Vascular Biology at Harvard Medical School and Boston Children's Hospital, and Professor of Bioengineering at the Harvard John A. Paulson School of Engineering and Applied Sciences.






用户评论