抗氧化剂修饰的干细胞有望修复辐射损伤的骨骼
骨肿瘤的治疗标准通常是双重的:手术切除癌变部分,然后进行放射治疗,以确保所有的癌细胞都被杀死。这是一种击败骨肿瘤的有效方法;然而,由于广泛的组织切断和辐射诱导的组织损伤,它经常导致较大的骨缺损和阻碍伤口愈合。一项新的研究发表在干细胞转化医学演示了阿魏酸诱导的干细胞如何修复这种骨损伤,以及这是如何发生的。这项研究提供的信息可能有助于开发治疗放射性骨损伤的新疗法。
北京放射医学研究所(BIRM)的医学博士朱恒和中华人民共和国空军医疗中心的医学博士丁立是这篇论文的共同通讯作者。BIRM的同事Liang Jia-Wu M.D和Li Pei-Lin M.D是共同第一作者。
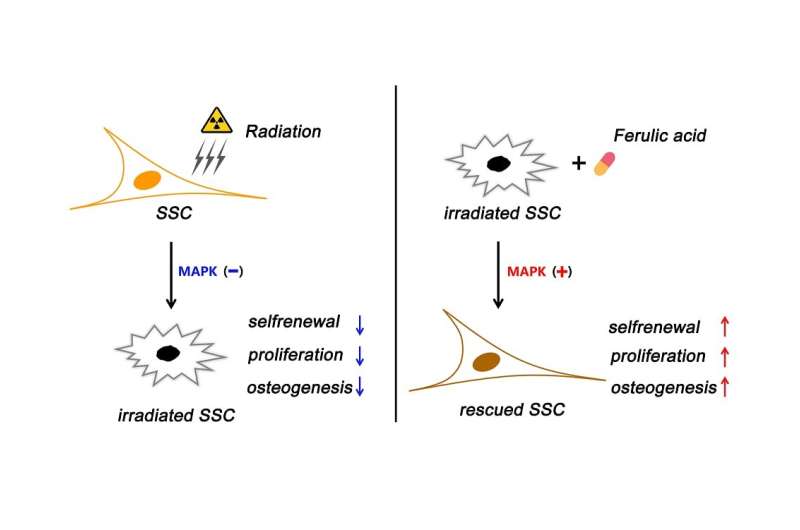
的主要担忧之一放射治疗它损害了骨骼干细胞(ssc)的“干性”,这意味着它影响了它们自我更新和分化的能力,而这是对干细胞至关重要的资产骨再生和修复,”朱博士说。“尽管如此,关于辐照后SSC茎干性的变化和相关的潜在调节因素的信息很少。这限制了我们对基于造血干细胞的骨再生的理解水平。”
在寻找一种方法来限制辐射对造血干细胞的有害影响时,朱博士和他的团队对阿魏酸(FA)产生了兴趣。FA是一种有效的抗氧化剂,常见于水果和蔬菜中,具有很强的抗炎特性,已广泛应用于预防心血管疾病、糖尿病、癌症等。它也被认为可以减轻辐射引起的干细胞损伤。
“鉴于ssc在骨再生中的基本作用和FA在辐照保护中的潜在作用,我们假设FA联合ssc可能有效地重建辐照骨缺损。我们用体外细胞模型和体内动物模型来探索这个想法。此外,细胞和分子机制我们还研究了FA对造血干细胞的保护作用,”丁博士说。
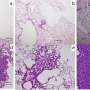
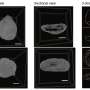
在他们研究的体外阶段,研究人员将辐照过的scc和未辐照过的scc播种到培养板上,然后添加不同浓度的FA,以确定FA对SSC增殖、分化和自我更新的潜在影响。
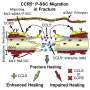
为了探讨SSC对动物模型辐照后骨缺损的修复能力,对小鼠后肢和下腹进行局部照射,1小时后进行骨缺损手术。接受手术的未辐照小鼠作为骨缺损对照组。然后将含有fa启动的造血干细胞或单独的造血干细胞的微冷冻剂注射到辐照小鼠的骨缺损区域。在另一组受照射动物中使用相同浓度的微冷冻凝胶,作为对照。最后,将FA溶液注入辐照骨缺损中,研究FA对骨修复的影响。
然后在辐射后1周、2周和3周的间隔对结果进行评估。他们表明,FA通过激活p38/MAPK和ERK/MAPK通路,显著挽救了辐射诱导的ssc损伤,这是细胞中的蛋白质链,可将细胞表面受体的信号传递到DNA。因此,它们在增殖、分化、发育、转化、凋亡等复杂的细胞程序中发挥着重要作用。
此外,FA显著增强了辐照骨缺损小鼠ssc的骨修复效果。
“这项工作揭示了FA促进照射后骨骼干细胞干性的维持。它还定义了p38/MAPK和ERK/MAPK通路的激活作为调控FA活性的分子潜在机制,”Liang博士说,“值得注意的是,我们的数据显示SSC对辐射非常敏感,并表现出受损的干性,这为了解骨质疏松症和辐射后阻碍骨修复提供了新的信息。”
李博士补充说:“虽然先前发表的几项研究表明FA可以增强和改善干细胞的自我更新,并且其活性是通过激活p38/MAPK和ERK/MAPK途径介导的,但我们的研究首次证明FA增强了ssc的骨修复作用。”“因此,我们认为靶向造血干细胞有可能成为治疗辐照骨损伤的新策略。”
“在目前的研究中,有希望的数据表明,茎细胞与强抗氧化剂阿魏酸联合使用可增强骨骼的骨修复作用干细胞的主编安东尼·阿塔拉医学博士说干细胞转化医学维克森林再生医学研究所所长。“这些发现有一天可能会导致新的骨肿瘤治疗标准。”