乳腺癌引爆引信被发现
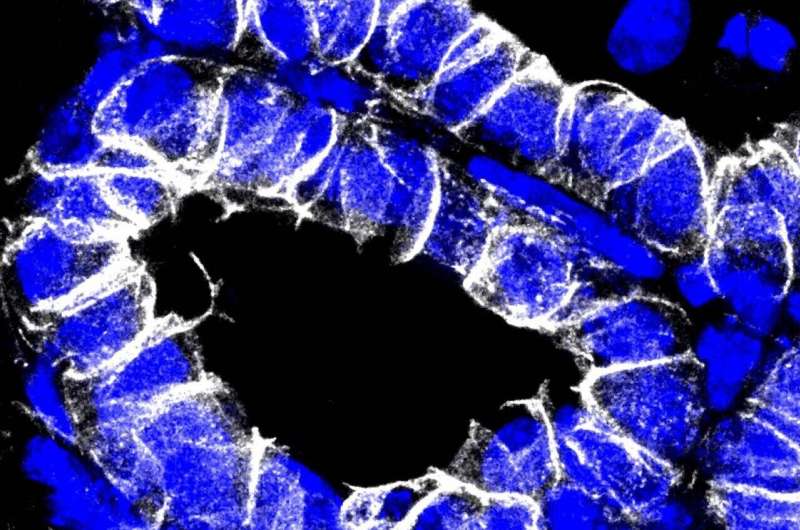
乳腺癌是女性最常见的肿瘤类型。仅在德国,每年就有6.9万例新确诊病例。大约80%的肿瘤起源于腔细胞,即乳腺的产乳细胞。10%的细胞与底层(基底)细胞层相似。这些是肌肉样的上皮细胞,当乳腺产生乳汁时,它们会收缩以将乳汁挤出体外。
虽然管腔性乳腺肿瘤通常对激素敏感,但80%的基底样肿瘤是三阴性。它们没有雌激素(ER)、孕激素(PR)或生长因子受体HER2,”Walter Birchmeier教授说。他领导着亥姆霍兹协会(MDC) Max Delbrück分子医学中心的信号转导发育和癌症实验室。由于目前没有针对这种极具侵略性的癌症的靶向治疗方法,受影响患者的预后很差。这些肿瘤很少对常规化疗药物有反应,这些药物旨在抑制细胞分裂。
在没有YAP的情况下,肿瘤在小鼠体内没有生长
在之前的研究中,Birchmeier的团队能够证明Wnt/ β -连环蛋白通路在基底样细胞的发育中起着关键作用乳腺癌.这种信号级联通常在胚胎发育期间调节细胞增殖和分化。Wnt对于-连环蛋白向细胞核传递信号至关重要。一旦细胞是成熟的,“工作已经完成”,这个反应链被禁用,β -连环蛋白被降解。然而,在某些类型的癌症中,信号通路可以被重新激活。在基底样乳腺癌的情况下,它被激活,β -连环蛋白在肿瘤细胞中积累。已知YAP癌基因在癌症干细胞.YAP蛋白刺激细胞生长,在细胞核中也很活跃。
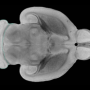
本研究旨在探讨Wnt信号与YAP之间的联系。该研究的主要作者,博士生Hazel Quinn在小鼠肿瘤生长开始时使YAP基因失活,其中Wnt信号通路被激活,基底样乳腺癌被诱导。研究发现,虽然对照组的小鼠在几周内长出了巨大的肿瘤,但在YAP敲除小鼠中没有发生这种情况。
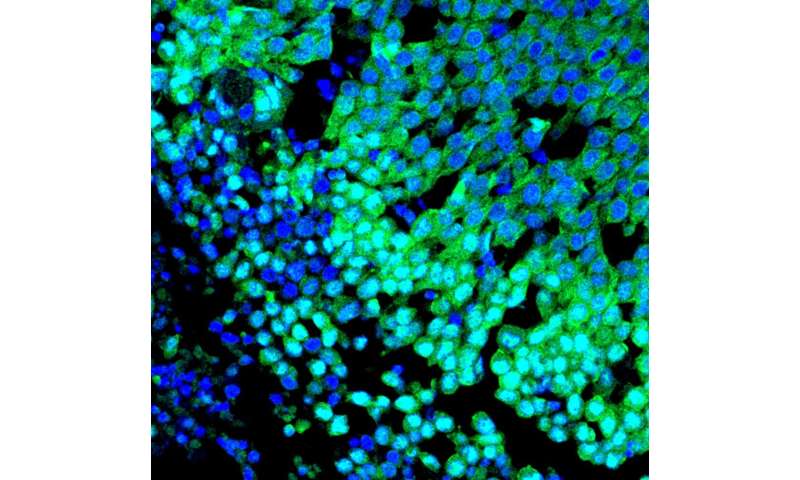
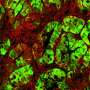
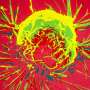
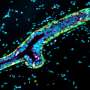
“在没有YAP的情况下,我们没有发现任何乳腺肿瘤。因此,YAP是肿瘤发展和扩散所必需的。”科学家使用染料和特异性抗体使组织切片中可见核内的YAP。当YAP基因失活时,形成并储存乳汁的小袋状结构肺泡很容易识别,并且没有肿瘤。它们在对照组的组织中几乎看不见,因为增殖的癌细胞取代了它们。
关于生存的结论
YAP是Hippo信号通路中的关键调控因子,几年前才被发现。它在干细胞的再生和分化中起着重要作用。如果它不能正常工作,癌症就会发生。“这也可能是YAP基因在基底样乳腺癌中高表达而在腔内乳腺癌中不表达的原因。基底样肿瘤的细胞与干细胞相似,而腔内肿瘤的分化程度更高,”Hazel Quinn解释道。
Quinn的合著者Philipp Mertins博士是MDC和柏林卫生研究所(BIH)的蛋白质组学分析专家和小组负责人,他对人类乳腺肿瘤组织样本进行了基因表达分析,并能够证实这一假设。虽然基底样肿瘤通常表现出高水平的YAP基因表达,但这些在腔内乳腺癌中显著降低。肿瘤中存在多少YAP也与患者的生存时间直接相关。“三阴性乳腺癌中YAP水平越高,女性死亡越早。在luminal的例子中乳房癌症,反之亦然,”黑兹尔·奎因解释道。
靶向治疗方法
癌症干细胞通常是小肿瘤簇在化疗后仍保留在组织中的原因癌症晚期复发并形成转移。与小鼠不同,人类的基因不能简单地失活。然而,好消息是YAP可以通过药物抑制。Hazel Quinn说:“我们现在知道YAP对这些细胞有多重要,不产生任何非特异性副作用的YAP抑制剂与传统治疗策略的结合可以提高患者的生存机会而不复发。”
奎因证明,这可以通过使用辛伐他汀或维特泊芬来抑制YAP活性,这两种物质已被批准用于治疗其他疾病。两种抑制剂均能显著减小肿瘤体积。“一家德国制药公司目前正在研究可以特异性抑制YAP的分子,”Walter Birchmeier补充说。可能需要一段时间才能发现一种高效且耐受性良好的新活性成分,并可用于临床。Birchmeier说:“在信号通路的不同点上使用不同抑制剂的联合治疗目前正受到青睐。”
进一步探索








用户评论