研究发现,在某些癌症中,高肿瘤突变负担预测免疫治疗反应,但不是所有癌症

根据德克萨斯大学MD Anderson癌症中心的研究人员领导的一项新研究,肿瘤内的高基因突变率,被称为高肿瘤突变负担(TMB),仅用于预测免疫检查点抑制剂在某些癌症类型中的临床反应。
研究结果发表在今天的《肿瘤学,建议TMB状态可能不能可靠地用作预测免疫治疗反应的通用生物标志物。而TMB状态能够成功预测对检查点封锁在某些癌症中,如黑色素瘤,肺癌和膀胱癌在美国,其他癌症(包括乳腺癌、前列腺癌和脑癌)的治疗结果并没有改善。
“这项研究代表了迄今为止对TMB作为免疫检查点封锁反应的生物标志物的最全面的分析,”系统生物学博士后Daniel J. McGrail博士说。“我们的研究结果不支持将高TMB状态作为免疫治疗反应的通用生物标志物,这表明额外的肿瘤需要进行类型特异性研究来阐明如何最好地应用TMB状态癌症这些类型似乎与结果无关。”
肿瘤内的基因突变会导致突变蛋白或新抗原的产生,免疫系统会识别出这种突变蛋白或新抗原的异常。McGrail解释说,由此可见,高TMB会使肿瘤更具免疫原性,这就是TMB状态成为预测免疫治疗反应的主要候选生物标志物的原因。
2020年6月,美国食品和药物管理局批准了抗pd -1疗法pembrolizumab,用于治疗TMB高的晚期和难治性癌症患者(由确定的突变阈值水平指示)。批准是基于II期KEYNOTE-158研究的结果,该研究发现高TMB患者的整体反应有所改善。然而,该试验没有包括几种癌症类型,如乳腺癌、前列腺癌和脑癌,这些癌症通常对免疫检查点封锁疗法没有反应。
系统生物学教授、资深作者shiwai - yih Lin博士说:“FDA批准pembrolizumab用于高TMB患者当然为许多患者提供了一个重要的选择。”“然而,我们认为更密切地观察TMB在更广泛的癌症类型组中的状态是重要的,并建立各种方法来协调TMB在各种化验中,使临床医生能够最好地利用最近的FDA批准。”
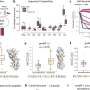
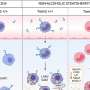
研究人员分析了来自癌症基因组图谱(TCGA)的31种癌症类型的超过10,000个肿瘤,以研究TMB状态和肿瘤免疫原性之间的关系,通过免疫细胞(CD8+ T细胞)浸润到肿瘤中来测量。他们确定了两类肿瘤——TMB状态与T细胞浸润之间有强相关性的肿瘤和无强相关性的肿瘤。
作者预测TMB状态不能同样预测这两组的免疫治疗反应。他们使用之前发表的研究和MD Anderson的患者队列进行了评估。
对于TMB状态与T细胞浸润有很强相关性的癌症,TMB高的患者有更好的临床结果。在这一类的所有癌症类型中,TMB高的患者对检查点抑制剂的总有效率为39.8%,显著高于TMB低的患者。
相比之下,TMB状态不能预测第二类肿瘤的预后。在这类患者中,TMB高的患者总有效率为15.3%,实际上低于TMB低的患者的有效率。
McGrail说:“虽然TMB状态在预测几种癌症对免疫检查点封锁的反应方面确实显示出了价值,但这并不能推广到所有癌症。”“对于那些高TMB似乎没有增加免疫原性的癌症类型,需要更多的前瞻性研究来确定TMB状态是否可以作为一种有效的临床生物标志物以及在什么阈值。”
此外,研究人员发现,与全外显子组测序相比,通过对癌症相关基因的靶组测序来评估TMB状态可能会高估TMB,而全外显子组测序提供了一种无偏倚的方法。McGrail解释说,虽然整个外显子组测序在临床环境中是不可实现的,但定义高TMB状态的阈值可能需要以癌症类型特异性的方式进行评估。
作者指出,这项研究受到了各种DNA测序方法的回顾性分析的限制,以及在免疫抑制剂检查站不同队列报告的临床结果包括。
进一步探索