科学家开发新的血小板配方组合抗癌治疗
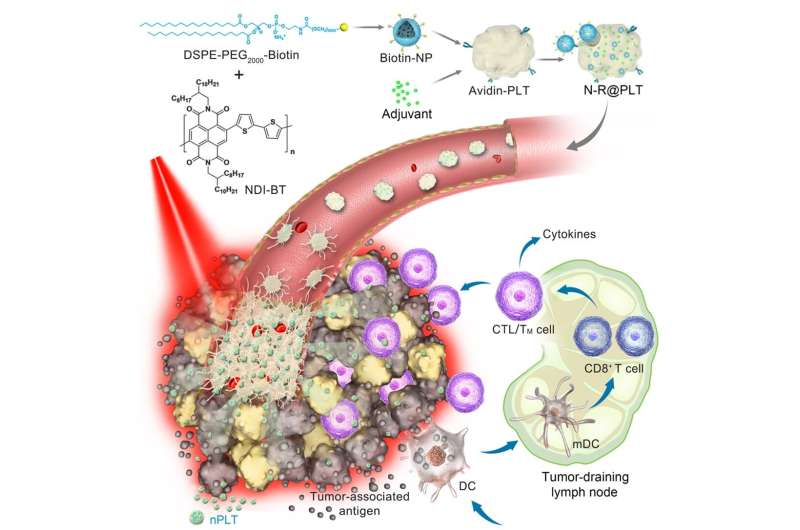
肿瘤靶向和肿瘤内渗透是癌症治疗的长期问题。
中国科学院过程工程研究所和中国科学院大学的研究人员开发了一种基于血小板的新配方,在小鼠模型中显示了强大的抗癌作用。
科学家利用血小板的聚集和激活特性来解决肿瘤靶向和肿瘤内穿透。通过携带光热纳米颗粒和免疫刺激剂,这种仿生配方也实现了对多种癌症的有效联合治疗。
这项研究发表在科学推进3月26日。
最近,光热疗(PTT)引起了越来越多的关注。虽然有希望的,高效的PTT交付仍然面临着一系列问题。由于癌症的异质性和紧凑的细胞外基质,对大多数抗癌疗法限制了光敏剂,特别是在肿瘤部位的光敏剂的积累和随后的肿瘤渗透。
作为一种新型的递送载体,血小板已经通过多种机制显示了它们将货物递送到肿瘤部位的能力,这表明它们是肿瘤靶向和腹腔内渗透的合理候选者。
热疗可以诱导肿瘤细胞释放抗原。这种反应不仅揭示了PTT和免疫活化的潜在机制之间的固有关系,而且还鼓励PTT和免疫疗法组合进行改善的抗癌治疗。
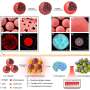
在这种基于血小板的新配方中,光热纳米颗粒和免疫刺激剂简单、温和、有效地整合到血小板中。
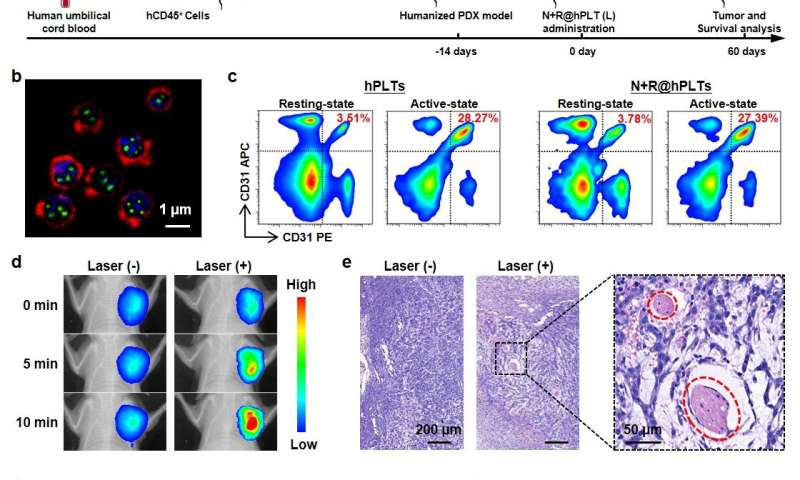
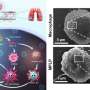
“这种新型光热纳米粒子的光热转化效率达到69.2%。因此,近近 -红外线(NIR)照射可以产生足够的局部热疗,”UCAS田志远教授说。
这种仿生血小板在血液中起着循环哨兵的作用,对血管损伤有敏感的反应。其结果是,其中一部分作为矛头,主要粘附在缺陷的肿瘤血管内皮细胞。
在用低功率NIR照射后,局部热疗导致急性血管损伤,随后诱导了增强血小板的聚集级联,以形成靶向库。
随后,在这些活化的血小板上进一步生成纳米尺寸的原血小板(nPLTs)。“我们观察到nplt将货物转移到深部肿瘤组织,扩大了攻击区域,”IPE的魏伟教授说。
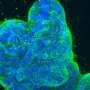
在光热治疗诱导肿瘤消融后,免疫刺激剂增强了释放的肿瘤相关抗原的免疫原性,从而进一步诱导机体的免疫反应来攻击残余、转移和复发的肿瘤。
该研究表明了强有力的治疗效果低电量9种不同小鼠模型的近红外辐射,最值得注意的是,一个基于人类血小板,人源化小鼠和病人来源的肿瘤异种移植(PDX)的复杂模型。
“这些结果对利用这种新型生物摩擦感血小板高性能和联合抗癌疗法的平台,“来自IPE的Ma Guanghui教授说。
一个同行评审员科学推进说这项研究是“组织良好的。”审稿人还强调,“该系统在肿瘤中非常有效治疗并已在不同的肿瘤模型中显示,我非常喜欢将此工作视为临床应用。“
进一步探索










用户评论