关键蛋白的差异可能指导SARS CoV-2感染者的命运
在围绕SARS CoV-2的许多令人困惑的问题中,也许最棘手的问题是:为什么这种疾病似乎以如此偶然的方式袭击,有时会让100岁的祖母幸免,而杀死健康的年轻男女?
亚利桑那州立大学生物设计研究所的Karen Anderson, Abhishek Singharoy及其同事的一项新研究可能会提供一些试探性的线索。他们的研究探索了MHC-I,一种关键的蛋白质人体适应性免疫系统的组成部分。
研究表明,某些变体形式的MHC-I可以通过刺激强烈的免疫反应来帮助保护身体,而其他变体形式的MHC-I可能会使个人容易受到病毒攻击,严重疾病,甚至死亡。
安德森说:“我们的发现意味着,对SARS-CoV-2产生强烈而多样的T细胞反应的能力可能对限制疾病严重程度很重要。”“这项工作的关键是利用蛋白质结构来预测个体MHC-I肽的结合能力。”
安德森是弗吉尼亚·g·派珀生物设计个性化诊断中心的研究人员,也是亚利桑那州立大学生命科学学院的教授。辛格罗伊是应用结构发现生物设计中心的研究员,也是亚利桑那州立大学分子科学学院的助理教授。
细胞的警察
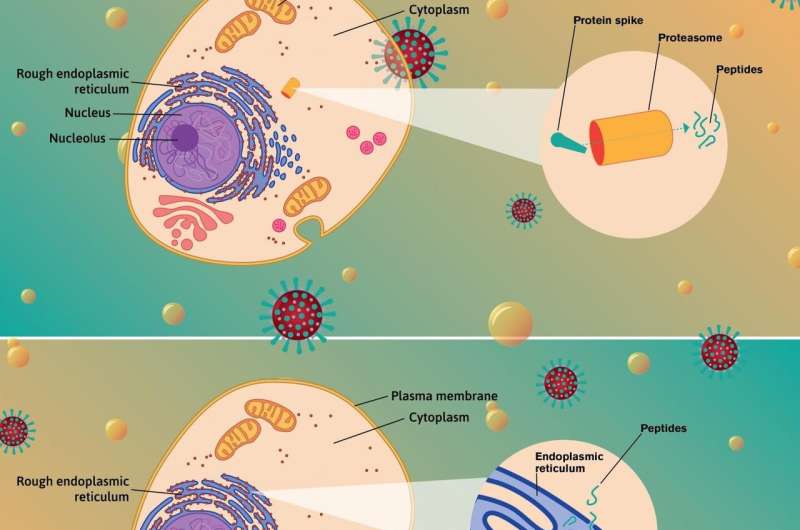
像所有脊椎动物一样,人类在所有有核的细胞中都携带MHC-I分子细胞.MHC-I的核心作用是帮助身体清除病毒和其他病原体的感染。它通过收集病毒片段,将它们运送到细胞表面,并将它们提交给被称为CD8+ T细胞的免疫剂,这些免疫剂不断地在体内巡逻。
然而,MHC-I是一种多态分子,这意味着它以多种形式存在,其结合病毒片段并将其呈现给T细胞审问的能力显著不同。根据存在哪些MHC-I变体或等位基因,人体可能对SARS CoV-2产生成功的免疫反应,也可能无法产生免疫反应,使人体变得脆弱。
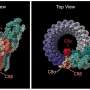
在杂志上发表的新研究中细胞报告医学Anderson, Singharoy和他们的同事描述了一种被称为EnsembleMHC的复杂算法,旨在预测哪些MHC-I等位基因最擅长结合病毒片段并将其提交给T细胞。他们还鉴定出108种来自SARS CoV-2结构蛋白的病毒肽,这些肽被认为是免疫反应的有力刺激剂。
Singharoy说:“这是SARS-CoV2激增的分子流行病学的第一个例子。”由(第一作者)埃里克·威尔逊(Eric Wilson)开发的从分子属性到群体属性的缩放是相当新颖的。”
威尔逊是生物设计研究所和亚利桑那州立大学分子科学学院的研究员。
影响范围
这项研究检查了52个常见的MHC-I等位基因,发现它们在结合源自SARS CoV-2完整基因组的病毒片段以及来自被认为是产生强大免疫反应的最重要病毒蛋白质的关键结构成分子集的病毒片段方面的能力存在显著差异。这些基本蛋白质帮助病毒组装4种关键结构,被称为S (Spike)、N (Nucleocapsid)、M (Membrane)和E (Envelope)蛋白。
CD8+ T细胞能够识别这些结构蛋白上的对接区域,即表位。当这些巡逻的免疫细胞遇到S、N、M和E蛋白时,它们通常会瞄准被感染的细胞进行破坏。
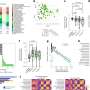
当研究人员比较来自23个国家的COVID-19数据时,他们发现这种疾病的死亡率与MHC-I变异的分布密切相关。具体而言,富含被列为SARS CoV-2肽片段强结合物的MHC-I等位基因的人群显示出较低的COVID-19死亡率,这表明这些有利的MHC-I等位基因在遇到新冠病毒时产生了强大的免疫反应冠状病毒.
这项工作对监测个人和人群对COVID-19的脆弱性具有重要意义,也可以帮助研究人员找出SARS CoV-2病原体的基本成分,这些成分最能刺激免疫反应,这是未来疫苗的关键组成部分。
防御措施
MHC- i分子由MHC基因产生,MHC基因是整个人类基因组中最具多态性的部分。已知MHC编码超过160种不同功能的蛋白质,其中一半直接参与免疫反应。MHC-I蛋白的巨大多样性为人体提供了强大的早期预警防御系统,能够结合广泛的病原体片段并微调免疫反应。MHC-I分子的丰富多样性也使得像病毒这样的外来入侵者很难秘密地战胜所有潜在的结合分子。
进行监视的CD8+ T细胞有一种不可思议的区分自我和非自我的能力。如果T细胞不喜欢它们所看到的,当抗原呈递MHC-I分子显示它们所获得的片段时,CD8+ T细胞将终止受感染的细胞。
先前的研究表明,MHC-I组成中即使是微小的氨基酸差异也会产生深远的影响。一方面,一些MHC-I形式可能会促进炎症和自身免疫性疾病,如格雷夫斯病、牛皮癣、类风湿关节炎或多发性硬化症,在这些疾病中,健康的组织被认为是外来的。另一方面,MHC-I变体可能在结构上不具备与病毒或其他病原体的适当片段结合的能力,从而无法引发免疫反应。因此,MHC基因型被认为是一系列病毒感染后患者预后的关键决定因素。
MHC-I在组织移植病例中也起着重要作用,正如它的全称——主要组织相容性复合体所显示的那样。如果供体组织与受体不相容,MHC-I分子就会呈现供体组织的片段,这些片段会被T细胞识别为异体并受到攻击,这种现象被称为移植物-宿主排斥反应,这是另一种形式的自身免疫。
跟随保护的足迹
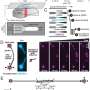
在目前的研究中,研究人员检测了MHC-I蛋白的52个常见等位基因,使用一种称为EnsembleMHC的定制设计算法来预测它们与SARS CoV-2蛋白片段的结合亲和力。编译了两组数据,第一组测量了每个等位基因对SARS CoV-2基因组中完整蛋白质库的结合亲和力。第二个数据集检查每个等位基因与S, N, M和E结构病毒候选肽的结合亲和力。
然后,研究人员挖掘了一个巨大的蛋白质等位基因数据库,将研究中52个等位基因的流行率与23个县相匹配。每个国家都得到了一个人口范围的分数,该分数结合了MHC-I结合能力和MHC-I等位基因频率。
在生育率较低的国家之间发现了令人信服的相关性死亡率在2020年1月至4月的研究期间,被EnsembleMHC鉴定为SARS CoV-2蛋白强结合分子的等位基因在人群范围内的高百分比。
此外,当仅比较那些对S、N、M和E蛋白表现出高结合亲和力的等位基因时,低COVID-19死亡率与这组有利的MHC-I等位基因之间的相关性最强,这再次表明病毒的结构蛋白在产生免疫反应方面最有效。
研究结果表明,具有能够与SARS-CoV-2结构蛋白多肽结合的MHC-I等位基因的患者可能会刺激增强的CD8+ T细胞反应,从而改善感染后的结果并降低死亡率。
这项新研究中描述的强大技术进一步揭示了MHC-I等位基因和免疫反应之间的微妙关系,并将帮助研究人员确定SARS CoV-2中最重要的免疫原性病毒片段,有助于未来的疫苗开发。将这些信息与患者的临床数据和基因谱结合起来,可能有助于确定那些患这种仍然难以捉摸的疾病的风险最大的人。
更多信息:Eric A. Wilson等人,总预测MHC-I表位负荷与SARS-CoV-2的人群死亡率呈负相关,细胞报告医学(2021)。DOI: 10.1016 / j.xcrm.2021.100221