基因治疗的新方法可以纠正基因内的任何疾病突变

使用CRISPR / CAS9系统的基因编辑的新方法绕过了基因中的疾病导致突变,使遗传疾病的治疗能够与单一基因相关的遗传疾病,例如囊性纤维化,某些类型的镰状细胞贫血和其他罕见疾病。通过Penn状态的研究人员在小鼠和人体组织培养中,在小鼠和人类组织培养中发育和测试,涉及插入扰乱突变基因的基因的新功能拷贝。
该方法的概念验证在于在线在ChinesK的在线出现分子治疗。
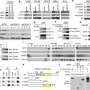
CRISPR / CAS9系统允许有希望的新基因疗法可以靶向和正确的疾病导致基因中的突变。在这个过程中,Cas9-A细菌蛋白切割在特定位置的DNA,其中遗传序列然后可以在修复DNA之前被编辑,修剪或插入的新序列。但是,目前的修复策略存在两个主要限制。首先,常见的修复策略称为同源导向的修复,需要使用仅在细胞分裂期间仅存在的细胞内的特异性蛋白质,这意味着基因修复过程不能在很少发生细胞分裂的大多数成年组织中使用。
“第二个挑战来自这样一个事实,即即使疾病是由a单基因,它可能是由该基因的各种不同突变引起的,“宾夕法尼亚州邦恩和高级作者的生物学教授。”随着同源性的修复,我们需要设计和测试策略每一个突变中的每一个,这可能是昂贵且时间密集的。在本研究中,我们设计了一种称为共同调节旁路修复(CRBr)的方法,其可用于分割和非分割细胞和组织和基因内的突变。这种方法对于由单一基因引起的稀有遗传疾病特别有前途,其中有限的时间和资源通常能够对诸多可能的疾病引起的突变进行设计和测试。“
CRBR利用CRISPR/Cas9系统和一种称为非同源端连接的细胞修复途径,在a突变基因启动子区域 - 基因何时何时何种功能的遗传序列和基因的突变部分。新插入的序列包含用于代替突变版本的正常基因的浓缩版本。插入序列结束时的终止子序列可防止使用剩余的下游突变基因。由于CRBR不依赖于同源导向修复所需的蛋白质,所以它可以用于所有类型的成人组织。
“我们的方法共同选择了一个基因的本土推动者,”宾夕法尼亚州邦的研究生jingjie hu说。“这意味着新插入的基因将在同一时间和细胞内的适当水平表达,作为其替代的基因。这是其他类型的基因疗法的优点,依赖于外部启动子以驱动高水平如果在某些生理条件下产生过多的基因的表达可能导致阴性效应或如果在某些生理条件下缺少基本调节反应。“
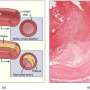
研究小组进行了一系列概念证明实验,以证明这种方法的效用。他们首先专注于Perk基因,突变可以导致罕见的疾病,称为Wolcott-rlalison综合征。综合征会导致从父母遗传的基因拷贝有突变 - 它是一种“隐性”疾病 - 并且可以引起新生儿糖尿病,骨骼问题,生长延迟等症状。
研究人员使用CRBr将Perk基因插入健康的小鼠中,并用在基因中具有突变的小鼠培育它们。含有一种CRBR编辑的PERK基因和一种突变的PERK基因的所得小鼠并没有与综合征相关的典型异常,表明CRRRR-edited基因可以在Wolcott-rollison的小鼠模型中拯救PERK基因功能综合征。
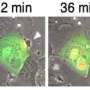
接下来,研究人员在实验室对人体组织进行了CRBR方法的测试,在这种情况下,重点是胰岛素基因。他们在人类尸体细胞的胰岛素基因启动子和胰岛素编码序列之间插入一个绿色荧光蛋白标记基因序列。该实验结果表明荧光蛋白在胰岛素分泌细胞中表达,而在其他类型细胞中没有表达,说明新序列在胰岛素启动子的控制下受到严格调控。
“我们的结果表明,CRBR基因修复可以在小鼠中恢复Perk基因功能,并揭示了CRBR在人类组织中进行基因修复的潜在效用,”Hu。
研究人员指出,用CRISPR/Cas9编辑基因很容易出错。例如,如果修复不能正常进行,同源导向的修复策略可能会潜在地在编码序列中产生破坏性突变。通过CRBR,研究人员将目标插入到基因的一个不编码蛋白质的区域,该区域应该更能容忍这些错误。
Cavener说:“像利用CRISPR/Cas9的CRBR这样的基因疗法仍然面临着将修复机制传递到相关细胞的挑战。”“一项有希望的进展是从患者身上分离出细胞或组织,在实验室中修复突变基因,然后移植修复的基因细胞或者组织回到病人体内。我们希望,随着研究人员不断改进分娩方式,CRBR可以用于治疗沃科特-拉利森综合征以及其他人类遗传疾病。”
进一步探索








用户评论