血管损伤的类型决定了它的再生路径
动脉粥样硬化和长期高血压等疾病会损伤血管。因此,血管可能会经历一个称为重塑的过程,即血管壁增厚并导致阻塞(称为闭塞)。在一项新的研究中,筑波大学的研究人员发现了血小板衍生生长因子受体α (PDGFRa+)标记的细胞是如何主要居住在最外层的血管中促进它们的重塑的。
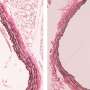
血管由三层组成,每一层在血管的功能和稳定中发挥着独特的作用:最内层(内膜)内衬内皮细胞调节血液和组织之间的交换;中层(中膜)由平滑肌细胞调节血液的张力船;最外层(外膜)包含各种细胞类型和结缔组织为血管提供结构的完整性和稳定性。内膜对病理状况非常敏感,如动脉粥样硬化和高血压,也对支架植入引起的血管闭塞(也称为支架内再狭窄)非常敏感。当内膜受损时,血管发生重塑,即平滑肌细胞在介质中繁殖,导致血管壁阻塞。虽然外膜细胞也参与了这一过程,但它们如何以及在多大程度上参与这一过程仍是未知的。
“新生内膜形成是血管疾病和支架植入的主要并发症,”该研究的主要作者Kenichi Kimura助理教授说。“因为它们导致了患者的总体发病率和死亡率,了解导致新生内膜形成的机制很重要,这样我们就可以为患者提供一种治疗方法。”在过去,人们对新内膜形成中介质的作用进行了大量的研究。因此,在这项研究中,我们想了解外膜细胞是如何参与其中的。”
为了实现他们的目标,研究人员使用了谱系追踪,并用荧光蛋白标记小鼠的PDGFRa+细胞。通过这样做,他们能够识别和跟踪细胞群及其后代。为了了解PDGFRa+细胞如何促进新生内膜的形成,研究人员应用了三种不同类型的损伤血管对小鼠进行颈动脉结扎(将颈部的主要血管结扎),剥去(用金属丝伤害血从血管内部)和压力超负荷(结扎大动脉以增加血压起源于主动脉的血管)。
有趣的是,研究人员发现PDGFRa+细胞的反应随着损伤类型的不同而不同。颈动脉结扎后,PDGFRa+细胞缓慢进入新生内膜,发育为未成熟的血管肌细胞,剥脱损伤后,这一过程加速,PDGFRa+细胞发育为成熟的血管平滑肌细胞。此外,压力超负荷损伤后,PDGFRa+细胞在外膜内增殖并产生结缔组织。“这些惊人的结果表明,PDGFRa+细胞对血管损伤的反应依赖于环境。我们希望我们的发现可以帮助提供一个新的治疗途径,影响新生内膜形成和血管闭塞的患者,”Hiromi Yanagisawa教授说。












用户评论