骨髓微环境促进乳腺癌转移性行为
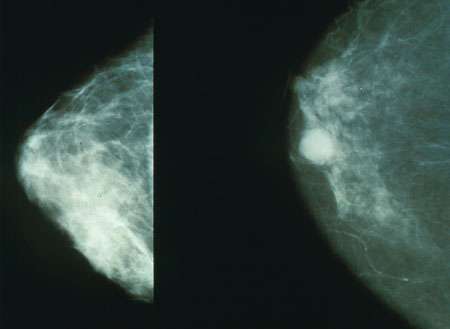
贝勒医学院带领的两项研究揭示了雌激素受体阳性(ER +)乳腺癌的未答复问题,乳腺癌有时会在骨骼中生长,并且尽管有有效的内分泌治疗指示,但仍然有效地向其他组织传播。
使用包括患者肿瘤样本的动物模型,团队发现了骨ER+ breast周围的微环境癌症细胞在这些细胞中减少了ER表达,导致对ER靶向内分泌治疗的抗性(在期刊上发表的结果细胞发育)。此外,骨髓微环境触发了重编程癌症促进它们转移或扩散到其他组织的能力的细胞(出版的结果细胞)。
“对其他器官转移是癌症相关死亡的主要原因,我的实验室对这一现象有兴趣多年,”通讯作者Xiang H.-f。张,威廉·巴特勒,M.D.赋予了贝勒的分子和细胞生物学教授的尊敬主席。“乳腺癌主要转移到骨骼;然而,它仍然是一个谜,为什么在超过三分之二的病例中,转移不会限于骨骼,而是随后发生在其他器官中并最终导致死亡。”
在这两篇论文中,张某和他的同事们应用了一系列模型和技术,他们以前开发的用于调查单个细胞分辨率的癌症骨相互作用,以查看ER +乳腺癌细胞在转移到骨骼时会发生什么。他们想了解可能导致他们对内分泌治疗的抵抗力,并增强转移到其他器官。
“令人惊讶的是,我们发现当ER+乳腺癌细胞位于骨骼中,它们降低了ER的表达,这使得它们不太容易受到针对ER的内分泌疗法的影响,”Zhang实验室博士后研究员、共同第一作者Igor Bado博士说。“我们确定,成骨细胞,即制造新骨的细胞,通过释放因子和与细胞的直接物理相互作用,促进了癌细胞的这种变化。”
有趣的是,与成骨细胞的相互作用也触发了基因表达的变化,使癌细胞具有类似干细胞的特性,如不受抑制的自我更新和分化为各种类型的细胞。作者解释说,有了这些特性,癌细胞就更有能力产生新的转移。
研究小组发现,骨微环境改变了癌细胞的许多代谢途径。“在这些途径中,ezh2介导的途径驱动ER+乳腺癌细胞朝向干燥的状态。抑制EZH2逆转内分泌抵抗力,“Bado说。
“EZH2正在成为治疗干预的主要候选者,”张说,他是麦克奈尔学者和贝勒丹·邓肯综合癌症中心的成员。
这些调查结果随时与Weijie Zhang博士在张实验室进行了联系。“与A相比,我们正在研究骨转移是否原发性肿瘤该研究的共同第一作者、张翔实验室博士后张维杰说。“我们发现骨骼的微环境就像癌细胞的‘动力站’,增强了它们进一步扩散到其他器官的能力。”我们的发现支持了这一观点,即许多转移可能不是由原发肿瘤引起的,而是由其他转移的进一步扩散引起的。”
研究人员还表明,骨骼微环境可以增强其他类型的癌症,如前列腺癌。
“这是其他人之前没有观察过的东西,”魏杰张说。“由于我们可以限制癌症的独特模型,我们能够发现这一点细胞骨头开始,允许我们随后的传播。“
“携带在一起,这些研究表明,骨微环境在转移过程中的未经证实的作用,并阐明了一种重编程过程驾驶终期,多器官转移酶,尽管内分泌疗法,但致张说。
进一步探索
细胞发育(2021)。DOI:10.1016 / J.DEVCEL.2021.03.008












用户评论