伴侣蛋白不平衡促进衰老脑中的有毒Tau累积
伴侣蛋白不平衡在启动老龄化脑中发起毒性的毒性积累可能发挥重要作用 - Alzheimer疾病发展的早期步骤和称为TauoPathies的相关神经退行性疾病,由南佛罗里达大学健康(USF Health)的新的临床前研究神经科学家建议。
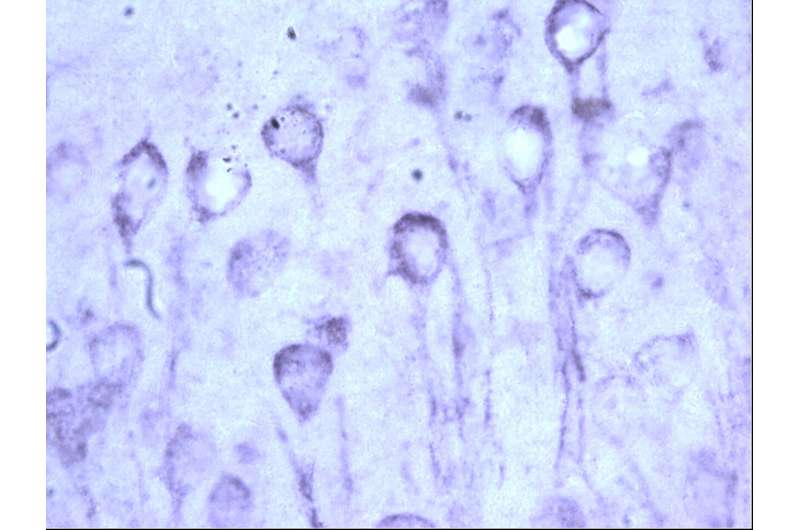
在人类中,蛋白质Tau的错误折叠导致其内部的毒性积累脑细胞,将这些Tau聚集成具有标志性神经纤维缠结,神经元死亡,最终症状的认知下降等记忆丧失和减少思维技能。
在这项研究中,USF健康Morsani医学院研究员使用了未转基因(野生型小鼠)的小鼠来检查AHA1和FKBP52的影响,两个共同伴侣热休克蛋白HSP90的蛋白质,在老化脑中。它们通过过表达这些旧宽型小鼠的AHA1和FKBP52的过度制定的分子伴侣不平衡。下面突出显示的发现4月8日在acta神经病理学通信中。
Hsp90是伴随着神经元和大脑中其他细胞的伴侣蛋白。通常,共伴侣蛋白有助于伴侣蛋白在监测和维持对细胞健康的蛋白质的平衡(稳态)。
“伴侣蛋白网络是您的细胞自然防御,以维持整个生命的稳态,并强调保护老化大脑的平衡的重要性,”劳拉·布莱尔(Ph.)担任分子医学助理教授USF Health Byrd Alzheimer中心,Morsani医学院。“我们很兴奋地使用这种新模型的跨部门疗法在寻找恢复伴侣蛋白平衡以延迟或停止阿尔茨海默氏症和其他神经变性疾病的进展的方法。”
在许多质量控制功能中,伴侣蛋白网络确保蛋白质被折叠成符合适当的3D形状,精确地运输,在需要工作的情况下,如果它们被异常修改或不再有用,则会被推动到劣化。热冲击蛋白如HSP90,当细胞处于应力下时触发,在校正蛋白质错误折叠以防止聚集中发挥特别重要的“分类”作用。
“但在里面老龄化脑,伴侣蛋白的平衡换档并创造了一个不像通常有效的系统。Blair博士说,表达的大量伴侣分子减少了表达,较小但大幅增加,“。
增加年龄是阿尔茨海默病的最大的危险因素。因此,USF健康团队调查了单独的FKBP52和AHA1水平是否可以启动粉丝中老年野生型小鼠的病理特征 - 那些没有遗传操纵脑中的遗传操作以异常增加TAU聚集。
他们的新小鼠托管病模型的主要发现包括:
- 高水平的FKBP52,以及较小程度的AHA1水平,随着时间的野生型小鼠随着时间的推移增加TAU积累。
- 通过过表达的FKBP52促进的TAU积累,但不是AHA1,通过夸大神经元支持细胞的激活,即小胶质细胞和星形胶质细胞来相关。这是通过神经元和认知障碍的丧失补充。
现有的小鼠模型,包括添加或减去基因,引入Tau突变和种子小鼠大脑与人性Tau的那些,帮助科学家了解有关阿尔茨海默病和其他末端的潜在原因。然而,它们倾向于限制在正常和异常老化的背景下捕获神经变性的生理方面。
“我们希望这一点(伴侣不平衡)模型将有助于我们更好地了解Tau聚集和神经炎炎症的动态,包括病理事件之间的时序和连接,而无需直接调节一个途径或另一个途径,”Blair说。
布莱尔博士的团队已经设计了后续研究,以帮助解开,如果,Tau累积或神经炎性在导致时更具影响力脑老化期间的细胞毒性。这有助于确定哪些伴侣 - FKBP52,AHA1或其他 - 可能是恢复的最佳治疗目标选项蛋白质她说,平衡。
















用户评论