实验药物显示出对阿尔茨海默病的潜力
Albert Einstein医学院的研究人员设计了一种实验药物,在老鼠中逆转阿尔茨海默病的关键症状。该药物通过重新测量一种细胞清洗机制,通过消化和回收它们来消除不需要的蛋白质。该研究今天在线在线在线发布细胞。
“在老鼠身上的发现并不总是适用于人类,特别是阿尔茨海默氏症,”共同研究的领导者Ana Maria Cuervo说,医学博士,博士,罗伯特和Renée贝尔弗神经退行性疾病研究主席,发育和分子生物学教授,爱因斯坦老化研究所的联合主任。“但我们在研究中发现,促进小鼠阿尔茨海默氏症的细胞清洁能力下降,也会发生在该疾病患者身上,这让我们感到鼓舞,这表明我们的药物可能也对人类有效。”在20世纪90年代,Cuervo博士发现了这种细胞清洁过程的存在,称为伴侣介导的自噬(CMA),并发表了200篇关于CMA在健康和疾病中的作用的论文。
随着人们年龄的增长,CMA的效率越来越低,增加了不必要的蛋白质积累成不溶性结块损害细胞的风险。事实上,老年痴呆症和其他疾病神经退行性疾病以有毒的表现为特征蛋白质患者脑中的聚集体。这细胞这篇论文揭示了CMA和阿尔茨海默病之间的动态相互作用,神经元中CMA的缺失导致阿尔茨海默病,反之亦然。这一发现表明,加速CMA的药物可能为治疗神经退行性疾病带来希望。
建立CMA与阿尔茨海默氏症的联系
Cuervo博士的团队首先研究了CMA受损是否与老年痴呆症有关。为了做到这一点,他们通过基因工程使一只老鼠的兴奋性大脑神经元缺乏CMA。一种类型的脑细胞中缺乏CMA足以导致短期记忆丧失、行走受损,以及在阿尔茨海默病的啮齿动物模型中经常发现的其他问题。此外,CMA的缺失严重破坏了蛋白质代谢——细胞调节其所含蛋白质的能力。通常可溶解的蛋白质已经变成不可溶性的,并且有凝结成有毒聚集体的风险。
Cuervo博士怀疑反过来也是正确的:早期的阿尔茨海默氏症损害了CMA。因此,她和她的同事们研究了一个早期阿尔茨海默氏症的老鼠模型,在这个模型中,大脑神经元被制造出tau蛋白的缺陷副本。有证据表明,tau蛋白的异常拷贝聚集在一起,形成神经原纤维缠结,从而导致老年痴呆症。研究小组专注于海马神经元中的CMA活动,海马是大脑中对记忆和学习至关重要的区域。他们发现,与对照组动物相比,这些神经元中的CMA活性显著降低。
那么人类早期的阿尔茨海默氏症呢?它也会阻断CMA吗?为了找到答案,研究人员观察了阿尔茨海默氏症患者死后大脑神经元的单细胞rna测序数据,以及一组健康个体的对照数据。测序数据显示了CMA在患者脑组织中的活动水平。果然,在阿尔茨海默氏症的早期阶段,CMA的活性受到了一定程度的抑制,而在阿尔茨海默氏症的晚期阶段,CMA的抑制作用更强。
Cuervo博士说:“当人们到了70或80岁时,CMA的活性通常会比他们年轻时下降约30%。”“大多数人的大脑可以弥补这种衰退。但如果再加上神经退行性疾病,对大脑神经元的正常蛋白质构成的影响可能是毁灭性的。我们的研究表明CMA缺陷与阿尔茨海默氏症病理相互作用,极大地加速疾病的进展。”
一种新型药物可以清除神经元并逆转症状
在一个令人鼓舞的发现中,Cuervo博士和她的团队开发了一种新药,显示出治疗老年痴呆症的潜力。“我们知道CMA能够消化有缺陷的tau蛋白和其他蛋白质,”Cuervo博士说。“但是阿尔茨海默氏症和其他神经退行性疾病中缺陷蛋白的数量超过了CMA,并在本质上削弱了它。我们的药物通过提高CMA关键成分的水平来重振CMA效率。”
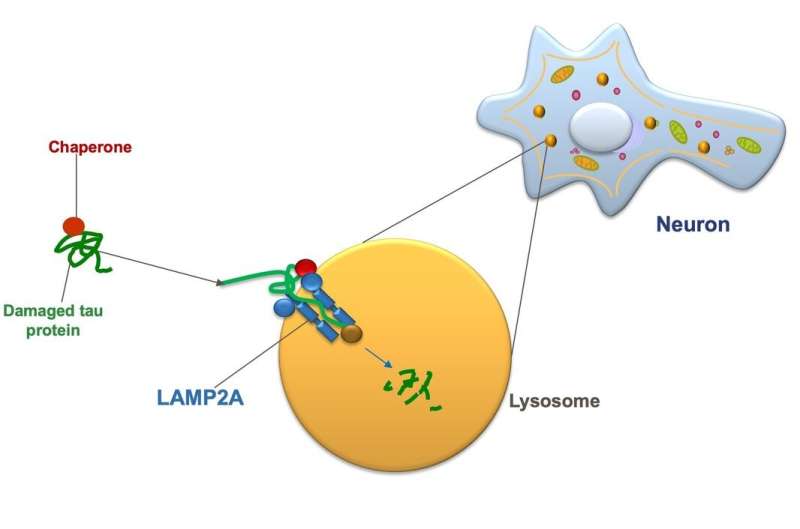
在CMA中,蛋白质称为伴侣,蛋白质在体内细胞中损坏或缺陷。伴侣将其货物渡过填充有酶的细胞的溶酶体膜结合的细胞器,其消化和再循环废料。然而,为了成功地将其货物转变为溶酶体,伴侣必须首先将材料“码头码头”。蛋白受体被称为从溶酶体的膜上发芽的灯光2a。溶酶体上的Lamp2a受体越多,CMA活性水平就越大。通过增加那些灯光2A受体的数量,叫做CA的新药物。
Cuervo博士说:“人一生中产生相同数量的LAMP2A受体。”“但随着年龄的增长,这些受体恶化得更快,所以老年人将多余蛋白质输送到溶酶体的可用受体往往更少。”CA将LAMP2A恢复到年轻水平,使CMA摆脱tau蛋白和其他缺陷蛋白,这样它们就不会形成那些有毒的蛋白质团块。”(同样是在本月,库尔沃医生也在接受采访团队报道自然通信那他们首次从阿尔茨海默氏症患者的大脑中分离出溶酶体,并观察到LAMP2受体数量的减少会导致人类CMA的丢失,就像在动物阿尔茨海默氏症模型中所做的那样。)
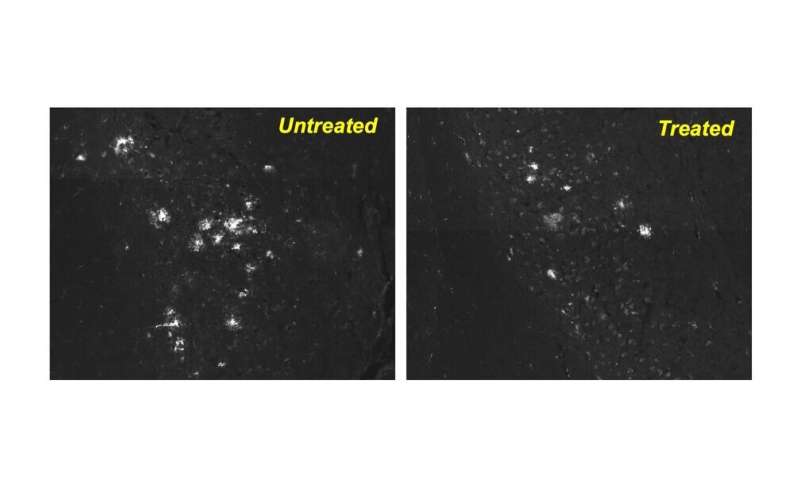
研究人员在阿尔茨海默病的两种不同小鼠模型中测试了CA。在两种疾病小鼠模型中,口服剂量的CA给予4至6个月,导致记忆,抑郁和焦虑的改善,使处理过的动物类似于或与健康的健康对照小鼠相似。步行能力在动物模型中显着改善,其中它是一个问题。在两种动物模型的脑神经元中,与未处理的动物相比,药物显着降低了Tau蛋白和蛋白质丛的水平。
“重要的是,这两个模型中的动物都已经出现了疾病症状,而且在给药之前,它们的神经元被有毒蛋白质堵塞了,”Cuervo博士说。这意味着这种药物甚至可以在疾病的晚期帮助保持神经元功能。我们也非常兴奋的是,该药物显著减少了胶质细胞增生——大脑神经元周围细胞的炎症和瘢痕。神经胶质瘤与有毒蛋白质有关,已知它在持续和恶化神经退行性疾病中扮演着重要角色。”
即使每天给予CA治疗一段时间,似乎也不会损害其他器官。该药物是由生物化学和医学教授,同时也是这项研究的共同领导者Evripidis Gavathiotis博士设计的。
博士。Cuervo和Gavathiotis与波士顿的生命生物学生,质量群体联系起来。,发现Selphagy治疗剂,目前正在开发CA和相关化合物,用于治疗阿尔茨海默和其他神经变性疾病。
该研究标题为“伴侣介导的自噬”伴随着神经元稳定性蛋白质组的崩溃。“该研究的其他联合领导者和第一作者是Mathieu Bourdenx,Ph.D.Cuervo实验室博士博士生,也是法国波尔多大学神经退行性疾病研究所的初级研究员。其他爱因斯坦作者包括:AdriánMartín-Segura,Aurora Scrivo,Susmita Kaushik,博士,Inmaculada Tasset,Ph.D.,Antonio Diaz和Yves R. Juste。
进一步探索









用户评论