线粒体和溶酶体关键在帕金森病中的相互作用
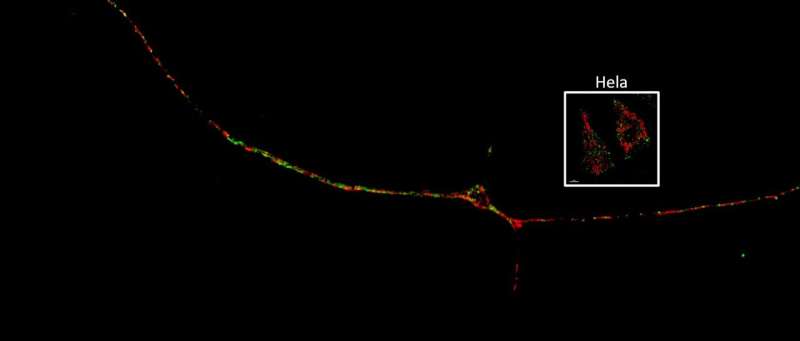
美国西北大学的医学科学家已经确定了人类神经元轴突和突触中线粒体和溶酶体接触的后果自然通信。
长时间接触,在神经元造型帕金森的疾病,导致线粒体的异常分布,有助于疾病的神经元功能障碍。根据Dimitri Krainc,MD,Ph.D.,主席和研究的亚伦蒙哥马利病房教授,研究人员将这种现象追溯到溶酶体酶β-葡聚糖雌激素酶(GBA)中的突变。
“我们的研究是第一个证明线粒体 - 溶酶体的接触地点在哺乳动物神经元动态形式,并且在帕金森病的疾病中误导,导致致病事件下游疾病,”克劳恩省也是神经遗传学赛苏森查雷雷西中心主任。
帕金森病是最常见的神经变性障碍之一,其中多巴胺神经元在真实性的NIGRA脑区域开始死,导致电机控制损失。Krainc表示,目前没有帕金森病的疾病改性帕金森病治疗涉及涉及病症的关键途径至关重要,涉及识别治疗目标。
Krainc实验室最近的研究发表在自然和科学-强调了线粒体和溶酶体功能障碍在帕金森病中的作用,提示这两个细胞器之间的直接信号传递可能是帕金森病的一个重要组成部分。
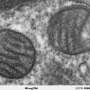
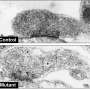
在目前的研究中,西北大学跨部门神经科学(NUIN)项目的五年级学生、该研究的主要作者Soojin Kim,利用超分辨率延时显微镜观察帕金森病患者神经细胞的树突和轴突中线粒体和溶酶体的相互接触。重要的是,她还发现,与正常神经元相比,带有gba功能缺失突变的神经元——被认为是帕金森病最严重的危险因素之一——显著延长了线粒体与溶酶体的接触。
“这表明线粒体-溶酶体接触的失调是疾病发病机制的重要一步,”Krainc说。
深入研究后,研究人员发现患者神经元中突变的GBA改变了线粒体-溶酶体接触的重要介质,导致神经元轴突中的线粒体减少,细胞能量来源ATP水平降低。
令人惊讶的是,通过上调TBC1D15蛋白来拯救这些下游效果,该蛋白参与线粒体 - 溶酶体系列。
“当我们在健康神经元中敲除TBC1D15时,我们看到了我们在患病神经元中观察到的表型,”Kim说。“当我们在患病的神经元中过表达TBC1D15时,我们可以部分挽救下游的病理表型。”
根据Krainc的说法,这些发现突出了线粒体 - 溶酶体触点作为线粒体功能的上游调节器,以及帕金森病中的复杂动力学驾驶神经变性。
“了解细胞器间联系的角色和调节对多个具有重要影响神经退行性疾病Krainc说:“这为了解帕金森病病因中线粒体和溶酶体功能障碍的汇聚提供了一个重要的前所未研究的角度。”
进一步探索









用户评论