治疗性癌症疫苗对多种肿瘤有希望

Marc Baum经历了所有通常的步骤,以治疗他的膀胱癌 - 这是一对手术,放射治疗和化疗,全部在三个月内。
但医生希望额外的一步 - 一个实验疫苗 - 将是鲍姆的癌症回来。
一种利用基因来教会人体免疫系统如何精确靶向癌症的疫苗已被证明是安全可行的早期临床试验根据刚刚在美国癌症研究协会(AACR)年会中报道的结果。
BAUM和12名其他患者在六个月内接受了一系列10种定制的疫苗接种。
57岁的鲍姆来自加利福尼亚州圣何塞,他对这些药物没有产生任何副作用,只是耸耸肩。
“这相当不平衡,”他说。“这很无害。”
实验室测试表明,镜头促进了一个免疫系统反应虽然它需要更大的后续试验,以判断接种如何杀死自由浮动的效果癌细胞,领导研究员托马斯·马隆博士,早期和免疫治疗试验助理董事,纽约市山西奈州伊坎科医学院的TISCH癌症研究所。
“随着时间的推移,我们实际上可以展示免疫系统的教育,”Marron说。“你可以看到t细胞的数量,也就是免疫系统中的白细胞,随着时间的推移慢慢增加。”
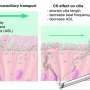
Marron表示,癌症甚至是最彻底的治疗甚至甚至最彻底的治疗,即使是最彻底的治疗甚至留下在成像测试中无法看到的微观癌细胞。
癌症研究一直在寻找使用免疫系统寻找和杀死这些细胞的方法,但免疫疗法的副作用可以是可怕的,因为对抗免疫系统对正常组织以及癌细胞造成损伤。
对抗各种癌症
利用这种最新的方法,研究人员对一个人的肿瘤和健康组织进行了深入的基因分析。然后,他们用电脑寻找仅在患者癌细胞中出现的特殊异常蛋白质。
“我们弄清楚与你们其他人相比,肿瘤的东西是什么,”Marron说。“我们可以识别最有可能教导你的免疫系统的10个最重要的东西识别。”
然后,团队从他们了解到你和你的肿瘤中学到的疫苗。
“我们在实验室中制作合成蛋白,看起来像肿瘤的蛋白质,然后我们将您接种疫苗,”Marron表示。“这种疫苗的目标是教导您的免疫系统识别您的癌症的外来蛋白质,因此您的免疫系统可以区分肺癌和正常的肺组织。”
Marron说,需要10个疗程,因为癌细胞和你自己的非常相似。
“在6次注射后,我们几乎看不到任何东西,但在10次注射后,也就是整整6个月的治疗后,我们看到你的免疫系统产生了真正强大的抗癌反应,”Marron说。
该早期试验中的13名参与者患有各种不同的癌症 - Marron表示,乳腺癌,膀胱,肺和颈部的多种骨髓瘤和癌症。
“在癌症中心看到我的每个人,他们的癌症与坐在他们周围的每个人都完全不同,他们的免疫系统与坐在他们周围的每个人都完全不同,”“马龙”
“非常有前途”
鲍姆于2018年3月被诊断出来膀胱癌在他尿液中发现血迹后。扫描显示他的膀胱有一个小病变。
“这就是所需要的,”Baum说。“它没有蔓延到任何地方,但它是在边缘。”
由于他的待遇于2018年7月结束,因此鲍姆仍然是无抗癌的,但参加了疫苗审判,因为他想要为科学做出贡献的计算机和电气工程师。
Dr.Baltimore of Johns Hopkins的助理教授Neeha Zaidis博士表示,这种疫苗可以攻击癌症而没有目前癌症治疗的严重影响。
“因为我们靶向仅在癌症上表达的特异性蛋白质细胞而不是在正常的细胞上,我们实际上能够减轻我们使用免疫疗法甚至化疗的许多副作用,“Zaidi说。
“在实际缩小肿瘤或造成临床反应的情况下,下一步将看出其疗效,或者致临床反应,”Zaidi继续。
Marron表示,使用这项技术已经使用这项技术进行了两项试验,其中一个具有脑肿瘤和另一个膀胱癌。
因为这些疫苗是高度个性化的,因此Marron指出,他们也非常昂贵。
但是,最终的希望是进一步的遗传测试最终将揭示在不同类型癌症中分享的特定异常蛋白质。然后,研究人员可以创造一个“现成的”疫苗,可以教导免疫系统来对抗多种癌症。
“如果我们可以使用我们所学习的一切并将其应用于现成的东西疫苗我们将能够更少的钱,并且不必在肿瘤和患者上做所有这些花哨的遗传测试,这显然会超级令人兴奋,“Marron表示。
这些调查结果是星期六在AACR的年度会议上展示,实际上持有。在医疗会议上提出的调查结果被认为是初步的,直到在同行评审期刊上发表。
进一步探索
版权所有©2021.健康天。版权所有。





用户评论