乳腺癌的扩散与新发现的RNA剪接机制有关
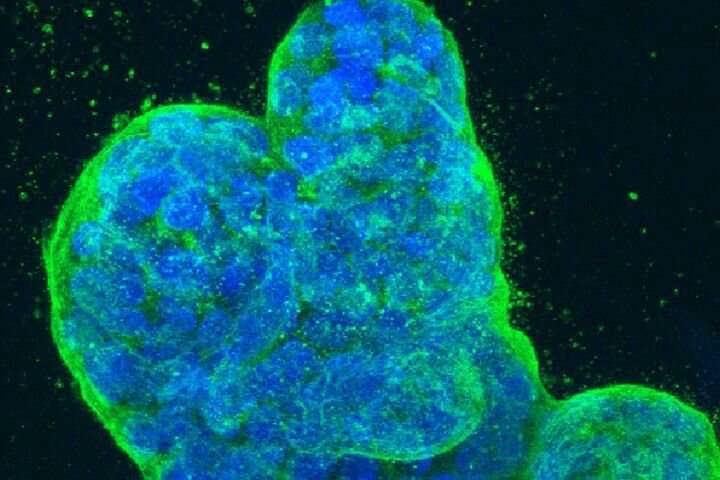
大多数死于癌症的人的死因并不是最初的肿瘤。肿瘤细胞在扩散到不同器官后不断扩大其数量,从而给机体带来难以忍受的疾病负担。
与已知的驱动早期的特定突变相比癌症生长——其中一些现在已经成为治疗的目标——研究人员对肿瘤内部新异常的持续积累以及它们最终是如何产生的了解较少癌细胞能够通过一种叫做转移的发展扩散到身体的其他部位。
近年来,科学家们已经越来越多的关于转移的发现,提高希望能够开发更好的治疗,以挽救具有晚期癌症的生命。事实证明,一种经常在转移中弹出的一种异常肿瘤细胞影响称为替代剪接的过程。
RNA结构驱动异常剪接
替代剪接决定,一旦将该基因的DNA转录到RNA中,该蛋白质将产生哪种蛋白质,该编码模板用于制备蛋白质的细胞内的工厂。与正常发育和功能所需的蛋白质数量相比,人类具有超过20,000个基因,相对较少。细胞可以以多种方式从给定基因中均衡并重新组合从给定基因产生的RNA模板,导致各种替代模板,每个模板各自产生独特的蛋白质。我们依靠这一过程来制造生产我们整个蛋白质的遗传学“食谱”。
科学家们发现,在癌症中会发生异常的选择性剪接模式,并导致这些相关但不同的蛋白质产生异常比例。
在5月14日《科学》杂志在线发表的一项新研究中,由生物化学和生物物理学系助理教授、加州大学旧金山分校海伦·迪勒家庭综合癌症中心成员哈尼·古达兹博士领导的研究人员进行的研究,在许多转移性病例中,由于异常的选择性剪接,一种称为胶凝蛋白的特殊变体产生过度乳房癌症。在健康组织中,Plectin在确定弹性和机械完整性方面发挥作用。
首先,UCSF科学家使用他们开发的计算技术来分析来自高转移性和较少的转移性乳腺癌细胞的RNA序列和结构。然后,它们鉴定了特定的RNA结构特征,其定义了与转移性癌症相关的替代剪接位点的子集。
古达兹说:“我们发现了一种以前未知的RNA结构,它可以增强剪接,并确定这种结构元素在高转移性乳腺癌中驱动异常的选择性剪接。”
通过阻止偏差RNA剪接的部位来停止转移
治疗转移性乳腺癌研究作者建议,可以靶向RNA剪接位点,其产生具有小比特互补的RNA的p1立方体的侵袭促进变体,所述互补RNA与剪接部位序列和块剪接结合。
在团队的实验中,这种方法效果降低了乳腺癌小鼠模型中转移的速率。类似的策略已经用于治疗脊柱肌营养不良症,其中异常替代剪接也起到作用。
增强该RNA位点剪接的机制以前也不清楚。研究人员发现a蛋白质被称为SNRPA1,在正常中发挥作用替代拼接作为一种被称为“剪接体”的协同分子组合的一部分,它也有一个副抓手,能够剪接研究人员发现的独特的胶凝素相关RNA基序。
古达兹说:“我们发现,SNRPA1的功能与人们熟知的SNRPA1不同,它是一种兼职,完全靠自己。”“在乳腺癌小鼠模型中,我们发现,通过结合RNA中的这种特定的剪接增强子,SNRPA1可以作为乳腺癌转移的启动子。”
研究人员还分析了1700多例乳腺癌病例的临床数据,并确定SNRPA1水平较高与乳腺癌患者的预后较差有关。
“基本上,这是一种驱动转移的生化途径,我们不知道它的存在,”古达兹说。
进一步探索













用户评论