新发现的介入骨髓瘤生长的表观遗传调节机制
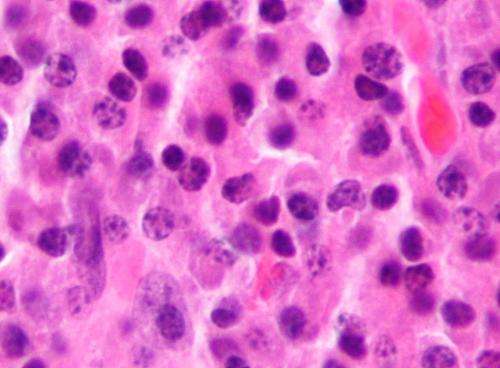
来自日本的国际研究人员,美国和英国已经分析了三种主要血液癌中的多发性骨髓瘤中的组蛋白脱甲基酶KDM5A的功能,并阐明了它促进骨髓瘤细胞增殖的机制。他们还开发了一种新型KDM5抑制剂,并显示它抑制骨髓瘤小鼠模型中的癌细胞生长。研究人员预计将来将开发针对KDM5A的新疗法。
多个预后骨髓瘤每年都在推出新的治疗剂,但仍然没有治愈。需要进一步阐明这种癌症的发病机制和治疗剂的发育。癌症的分子发病机制,包括多发性骨髓瘤,不仅与遗传改变有关,而且与表观遗传变化深度相关。表观遗传调节剂KDM5家族蛋白质在骨髓瘤中高度表达细胞,但他们的功能尚不清楚。
为了澄清KDM5家族蛋白在骨髓瘤细胞中的作用,来自熊本大学的研究人员和Dana-Farber癌症研究所使用遗传操作来抑制KDM5在人骨髓瘤细胞系中的表达。他们发现,在KDM5家族成员中,KDM5A特别对细胞增殖产生了强烈影响,促使它们分析其分子机制。他们还开发了一种新型KDM5抑制剂,并使用骨髓瘤患者细胞和骨髓瘤小鼠模型验证其功效。
KDM5A表达或KDM5的药理学抑制的遗传抑制抑制了骨髓瘤细胞的生长。此外,通过使用将人骨髓瘤细胞系移植到免疫缺陷小鼠中的骨髓瘤小鼠模型,研究人员证明其KDM5抑制剂甚至在体内抑制骨髓瘤细胞生长。功能分析表明,KDM5A与Myc配合,骨髓瘤发育和生长中的重要转录因子,促进Myc靶基因的表达。尽管在Myc靶基因的转录开始位点附近最初观察到高水平的组蛋白甲基化(H3K4ME3),但通过抑制KDM5A进一步增加这种改性水平。这表明过量的H3K4ME3用作转录的屏障,从而抑制与H3K4ME3促进转录的先前理论相反的转录。进一步的分析表明,KDM5a通过瞬时释放H3K4ME3从转录开始转录到转录伸长率时,可以帮助切换转录相关复合物。
该研究提出了一种新的表观遗传调节模型,其中KDM5A在转录开始部位调节组蛋白甲基化在所需阶段期间的最佳水平,从而促进MyC靶基因的转录和前导骨髓瘤细胞的转化。它还表明KDM5抑制剂抑制骨髓瘤细胞的生长。
“我们的研究阐明了由组蛋白修饰规则介导的骨髓瘤细胞增殖的一部分,并显示了针对KDM5A的疗法的潜力,”副教授Hiroto Ohguchi表示,他领导了这项研究。“KDM5家族也涉及其他癌的生长。迄今为止,KDM5抑制剂的问题是细胞膜渗透性较弱,并且在细胞或体内没有有效。但是,如果是治疗药物是基于本研究开发的KDM5抑制剂开发的,预计不仅为多种骨髓瘤发展到新的治疗策略,而且是各种其他类型的癌症通过将其与常规治疗方法相结合。“
这项研究在线发布血癌发现2021年4月10日。
进一步探索











用户评论