非营利组织,联邦政府超越制药导致阿尔茨海默氏病药物开发
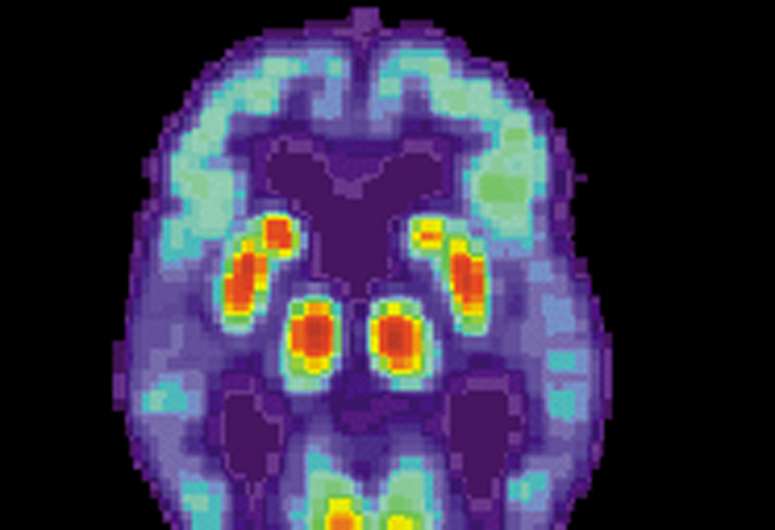
今天在线发表的两篇文章阿尔茨海默氏症和老年痴呆症:转化研究及临床干预措施阿尔茨海默氏病协会杂志》,表现出实质性的关注和资金的变化对阿尔茨海默病治疗的临床试验。新发表的文章使更多关注的抉择之前,美国食品和药物管理局(FDA)——可能会带来一个新的药物治疗阿尔茨海默氏症患者近20年来第一次。
研究人员分析了clinicaltrials.gov,美国国家医学图书馆的数据库,和五年的年度阿尔茨海默氏症管道UNLV综合健康科学学院发表的评论研究教授Jeffrey l .卡明斯和同事。结果捕获制药的众所周知的撤退从阿尔茨海默氏症的临床试验,特别是早期阶段人体试验,联邦机构和非营利组织的出现为增长和创新的主要驱动因素。
在第一项研究中,“谁基金阿尔茨海默病药物开发?”卡明斯和她的同事发现,阿尔茨海默氏症的临床试验支持的数量制药公司已经过去五年下降,而试验由联邦政府支持来源和公私合作伙伴关系(PPP)增加了。作者观察到制药公司不增加他们的参与和阿尔茨海默氏症试验药物发展除了通过购买力平价,使他们能够将成本和风险。他们基本上只参与晚期(阶段3)临床试验。
研究人员发现,这些试验差距是越来越多地由学术医学中心(资产管理公司)。试验由资产管理公司在过去的五年里上涨了78%,主要是由美国国家卫生研究院(NIH)和项目的国家老龄研究所(NIA),阿尔茨海默氏症协会和阿尔茨海默氏病药物发现基金会(ADDF),包括阿尔茨海默氏症协会的云计划的一部分。
“非营利组织和美国国立卫生研究院正在一个巨大的差异药物开发对阿尔茨海默氏病和其他痴呆。”卡明斯说。“近年来医药紧缩后的多个-临床试验,但也在早期试验的创新和重新评估之前资源不足的想法。我们发现在我们的审查,在更新的早期临床试验,治疗机制更加多元化,生物标志物更经常使用,搭建而成的代理正在explored-increasingly为首的学术研究人员和由国家卫生研究院资助,阿尔茨海默病协会和ADDF。
第二篇论文,”阿尔茨海默病药物开发管道:2021,”卡明斯和他的同事,包括学生,贾斯汀Bauzon,拉斯维加斯大学医学院,强化这些趋势表明,尽管制药公司的退出阿尔茨海默氏症,总数量的代理在阿尔茨海默氏症的临床试验已经相对稳定在过去五年。总略高于2020,由其他代理在第二阶段的研究。也有增加目标的多样性和阿尔茨海默氏症的药物治疗机制管道,由创新驱动阶段1和2试用。
“阿尔茨海默氏症协会资助,partnerships-including NIA和ADDF-and倡导联邦现在阿尔茨海默氏症研究经费增长的主要驱动因素在阿尔茨海默氏症临床试验,制药公司的撤退,留下的缺口日益增长和多样化的前端药物管道,”玛丽亚·c·卡里说,阿尔茨海默氏症协会首席科学官。
NIA现在每年分发超过30亿美元为阿尔茨海默氏症和老年痴呆症的研究,从几年前的5亿美元。“这个伟大的胜利几乎完全是由于阿尔茨海默氏症协会的立法努力,我们的基层支持者,在国会和我们的冠军,”Carrillo说。
FDA正在审查aducanumab(生原体)治疗阿尔茨海默氏症。预计将在6月7日的决定。
“如果制药公司没有看到一个清晰的路径FDA的批准,他们将继续投资于阿尔茨海默氏症,”卡明斯说。“这进一步强调的重要性之前FDA的决定。”
有四种药物批准,通常用于治疗阿尔茨海默氏痴呆的症状,加上一个包含两种药物联合治疗。目前没有批准的药物,改变或延缓疾病的进展,或推迟或停止临床下降。没有新药批准自2003年以来,阿尔茨海默氏症。
这篇文章的作者说,“如果监管当局批准的新疗法,赞助商和更多资金可能被吸引到阿尔茨海默氏症研究加速创新。”
这两项研究都支持Chambers-Grundy变革,拉斯维加斯大学神经科学中心致力于推进临床试验方法来获得更好的治疗病人更快。








用户评论