科学家发现儿童的新遗传形式的ALS

在研究11名医疗症状患者的研究中,由国立卫生研究院和穿制服的服务大学(USU)领导的科学家的国际研究人员发现了一种新的和独特的肌营养的外侧硬化剂(ALS)。与大多数ALS案例不同,该疾病在儿童时期开始攻击这些患者,比往常更慢地恶化,并且与一个称为SPTLC1的基因相关,即身体脂肪生产系统的一部分。初步结果表明,基因沉默的SPTLC1活动将是对抗这种类型的有效策略。
“Als是一种瘫痪,通常致命疾病,通常会影响中年人。我们发现这种疾病的遗传形式也可以威胁孩子。我们的结果首次表现出ALS可以由身体的变化造成的第一次metabolizes lipids," said Carsten Bönnemann, M.D., senior investigator at the NIH's National Institute of Neurological Disorders and Stroke (NINDS) and a senior author of the study published in自然医学。“我们希望这些结果能够帮助医生认识到这种新形式的ALS,并导致治疗的发展,将改善这些儿童和年轻人的生命。我们也希望我们的结果可以为理解和治疗其他形式提供新的线索这种病。”
Bönnemann博士领导了一支使用先进的遗传技术来解决世界各地最神秘的儿童神经疾病的研究人员。在这项研究中,该团队发现,这些病例中的11种具有与SPLTC1 DNA序列的变异有关的ALS,该基因负责制造称为鞘脂脂的各类脂肪的基因。
此外,该团队还与由Teresa M. Dunn,Ph.D.,USU教授和椅子领导的实验室的科学家合作,在瑞士苏黎世大学的Thorsten Hornemann,博士学位。它们不仅找到了线索,即如何变化SPLTC1基因如何导致ALS,而且还开发了一种抵消这些问题的策略。
该研究开始与来自意大利普利亚地区的一个年轻女子克劳迪娅DigRegorio。她的案件是如此烦恼,即教皇弗朗西斯在梵蒂冈队担任梵蒂冈之前,她留下了在NIH的临床中心的团队审查之前,教皇弗朗西斯在梵蒂冈致敬。
像许多其他患者一样,克劳迪娅需要轮椅移动,并进行手术植入的气管造口管以帮助呼吸。团队的神经学检查透露,她和其他人有许多ALS的标志,包括严重削弱或瘫痪的肌肉。此外,一些患者的肌肉在显微镜或非侵入性扫描仪在显微镜中检查时显示出萎缩的迹象。
然而,这种形式的ALS似乎不同。大多数患者被诊断为50至60岁的ALS。这种疾病随后迅速恶化,患者通常在诊断后三到五年内死亡。相比之下,初始症状,如脚趾走路和痉挛,在这些患者中出现在4岁以下的患者中。此外,在研究结束时,患者在5到20年的任何地方居住了。
“这些年轻的患者有许多占ALS的上下运动神经元问题,”帕卡姆Mohassel,M.D.,NIH临床研究员和该研究的主要作者。“这案例是独一无二的,是发病的早期和症状的速度较慢。这让我们想知道是什么是这种独特形式的als。”
第一个线索来自分析患者的DNA。研究人员使用了下一代遗传工具来阅读患者的展示,DNA的序列,其具有制备蛋白质的说明。他们发现患者在SPLTC1基因的相同窄部分中具有显着变化。四名患者从父母继承了这些变更。同时,另外六种病例似乎是科学家称之为基因中的“de novo”突变的结果。在概念之前或之后的细胞快速繁殖的细胞随后,可以自发地发生这些类型的突变。
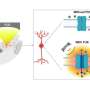
尚已知SPRTC1中的突变会导致具有遗传性感官和自主神经病变1型(HSAN1)的不同神经障碍。SPLTC1蛋白是一种称为SPT的酶的亚基,其催化制造鞘脂所需的几种反应中的第一反应。HSAN1突变导致酶产生非典型和有害的鞘脂版本。
起初,团队认为他们发现的als导致突变可能产生类似的问题。然而,来自患者的血液测试显示没有有害鞘脂的迹象。
“那个点,我们觉得我们遇到了一段路障。我们无法完全了解ALS患者中所见的突变如何没有显示出对SPTLC1突变所知的异常,”Bönnemann博士说。“幸运的是,Dunn博士的团队有一些想法。”
对于Dunn博士,Dunn博士研究了鞘脂的作用在健康和疾病中。在邓恩队的帮助下,研究人员从ALS患者中重新审查了血液样本,并发现典型的鞘脂的水平异常高。这表明ALS突变增强了SPT活性。
当研究人员在培养皿中生长的研究人员进行了类似的结果,以在SPLTC1中携带均导致的ALS导致突变。突变载体神经元产生比对照细胞更高的典型鞘脂。当Neurons进料氨基酸丝氨酸时,这种差异增强,是SPT反应中的关键成分。
以前的研究表明,丝氨酸补充剂可以是HSAN1的有效治疗方法。根据其结果,本研究的作者推荐在治疗ALS患者时避免丝氨酸补充剂。
接下来,Dunn的团队博士进行了一系列实验,表明ALS导致突变可防止另一种称为ORMDL的蛋白质抑制SPT活性。
“我们的研究结果表明,这些ALS患者基本上没有SPT活性的制动器。SPT由反馈回路控制。当鞘磷脂水平高时,ORMDL蛋白结合并减慢SPT。这些患者的突变基本短路反馈循环,“Dunn博士说。“我们认为恢复此制动器可能是治疗这种类型的良好策略。”
为了测试这个想法,Bönnemann团队创建了小型干扰RNA,旨在关闭患者中发现的突变SPRTC1基因。患者皮肤细胞的实验表明,这些RNA链均降低了SPLTC1基因活性的水平,并将鞘氨醇水平恢复到正常。
“这些初步结果表明,我们可以使用精确的基因沉默策略来治疗这种类型的患者。此外,我们还探讨了其他方法来踩到SPT活动的制动器,”Bonnemann博士说。“我们的最终目标是将这些想法转化为对目前没有治疗选择的患者的有效治疗。”
进一步探索















用户评论