内耳耳蜗内产生的超氧化物会导致获得性听力丧失
Ueyama Takehiko教授(神户大学生物信号研究中心)和内耳研究小组(京都医科大学)已经确定了内耳耳蜗中负责产生超氧化物的细胞类型(nox3表达细胞)。他们通过使用他们开发的转基因小鼠来实现这一目标。研究人员发现,这些产生超氧化物的细胞在衰老、噪音损伤和耳毒性药物的作用下数量增加,从而导致与年龄相关的、噪音诱导的和药物诱导的听力损失。此外,他们能够在未表达Nox3的转基因小鼠(Nox3敲除)中抑制这三种类型的获得性听力损失的发生。
预计这些结果将有助于开发世界上第一个基于药物的听力损失治疗方法。未来的治疗可能包括从耳蜗中去除活性氧,抑制其产生,或开发Nox3抑制剂。
这些研究结果发表在神经科学杂志2021年4月12日。
感音神经性听力损失是感音神经性损伤中最常见的一种。全球约5%的人口患有某种类型的听力障碍;然而,对于这些情况,仍然没有确定的治疗方法,特别是药物干预。
据说,在65岁以上的成年人中,25%-40%的人会出现与年龄有关的听力损失,仅在日本就有大约1000万人患有这种疾病。噪音引起的听力损失仍然是退伍军人最常见的后遗症之一;然而,他们并不是患上这种障碍的唯一人群。根据世界卫生组织2019年的一份声明,由于智能手机等便携式媒体播放器的普及导致过度暴露在高噪音水平下,未来约有50%的12-35岁年轻人(11亿人)面临噪音性听力丧失的风险。还有药物性听力损失,这可能是服用抗生素、抗癌药、利尿剂、止痛药和消炎药等药物的副作用。因此,在现代社会中,听力损失的人数不断增加,开发治疗方法已成为一个紧迫的问题。
NADPH氧化酶(Noxs)产生的超氧化物是一种活性氧,有助于不同类型的感音神经性听力损失的发展。在人类体内发现的7种Noxs中,有报道称,在内耳中特异性表达的Nox3是超氧化物的起源。然而,细胞类型在内耳耳蜗中表达Nox3的基因尚不清楚,也不清楚Nox3何时表达、如何表达。它导致听力损失的机制也不清楚。
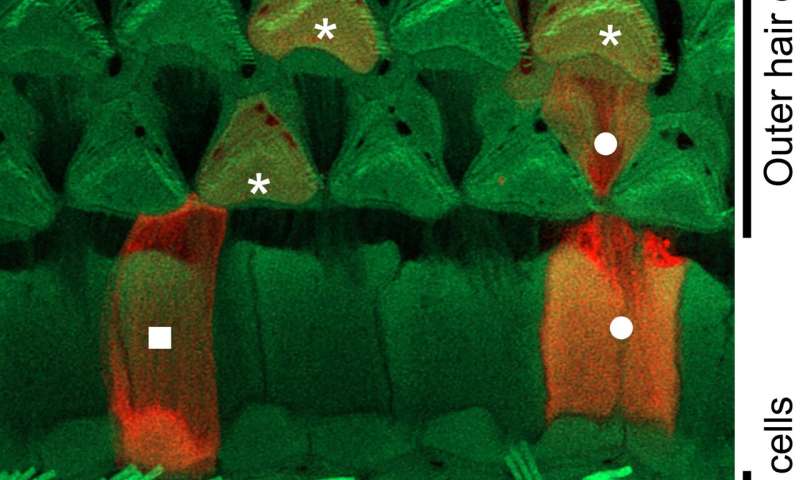
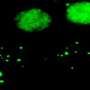
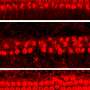
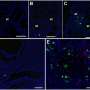
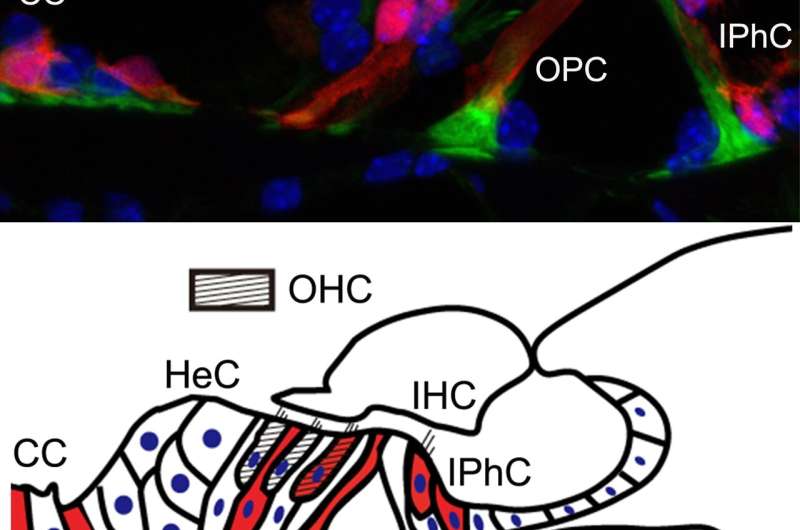
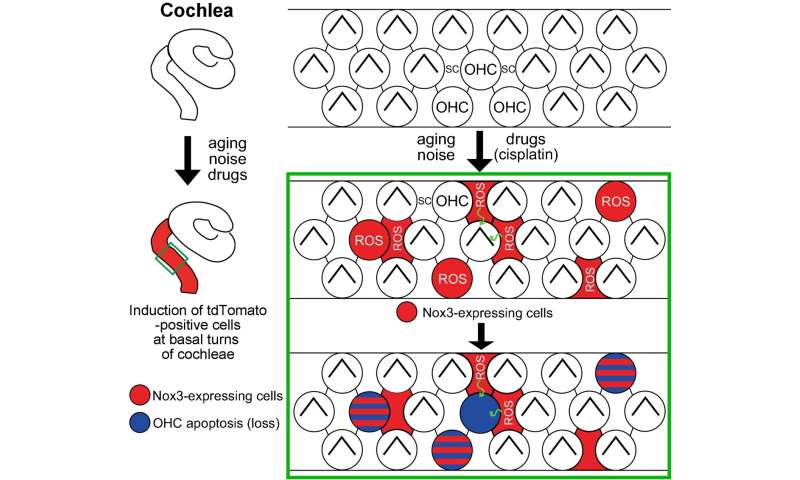
该研究小组使用基因操作创建了许多小鼠模型,以调查患者听力损失的原因并为他们开发治疗方法。在这个实验中,他们开发了一个小鼠模型(Nox3- cre;tdTomato),其中红色荧光发光蛋白(tdTomato)将在表达Nox3的细胞中表达,以及一个Nox3敲除小鼠系(Nox3- ko),其中Nox-3无法表达。通过使用这些小鼠,他们能够识别出Nox3-在内耳耳蜗(负责听力)表达细胞,换句话说,就是负责产生超氧化物的细胞(图1和图2)。此外,他们还揭示了Nox3在以下所有主要类型的获得性听力损失的发病中起着重要作用:年龄相关性听力损失、噪声性听力损失和药物性听力损失(图3)。
首先,研究人员在表达nox3的细胞中使用了红色荧光tdTomato蛋白的小鼠,并使用荧光显微镜跟踪小鼠出生后细胞中红色荧光的短暂表达。他们发现耳蜗(负责听力)内以下细胞的红色荧光增加:毛细胞不同类型的支持细胞(为毛细胞提供解剖学支持)和螺旋神经节神经元(连接毛细胞的听觉的第一个传入神经元)(图1和图2)。
内耳内的两种类型的毛细胞;外毛细胞比内毛细胞更容易受到各种外界刺激。在外毛细胞的损失是一个已知的表现在许多情况下的听力障碍。研究小组使用两种不同类型的转基因小鼠详细研究了这一点:保留了nox3介导的产生超氧化物能力的小鼠(杂合子Nox3-Cre)+/-tdTomato)和去除了这种能力的小鼠(纯合子Nox3-Cre+/+; tdTomato)。在保留了产生超氧化物能力的第一组小鼠中,内层毛细胞从tdTomato蛋白中发出红色荧光(换句话说,它们表达了Nox3)。然而,在外耳细胞中未观察到Nox3,无论老化、噪音或顺铂诱导(顺铂是一种众所周知的抗癌药物,其副作用是听力损失)。使用后一组小鼠(无法产生超氧化物),研究人员发现,表达荧光tdTomato蛋白的细胞数量(换句话说,最初具有表达Nox3能力的细胞)在衰老、噪音和药物诱导下有所增加。根据这些结果,他们确定了表达nox3(即产生超氧化物)的外毛细胞被超氧化物中毒并死亡(凋亡)。此外,研究人员还发现,即使外层毛细胞本身不表达Nox3,其周围支持细胞产生的超氧化物也可能导致外层毛细胞的损失。
该团队使用Nox3- ko小鼠研究了Nox3对年龄相关、噪音诱导和药物诱导的听力损失的影响,发现与野生型小鼠相比,Nox3- ko小鼠更容易抑制所有这些类型的听力损失的发作和程度。他们还发现,与噪音引起的听力损失相比,它们可以更大程度地抑制与年龄有关的和药物引起的听力损失。
此外,研究人员发现,在老年小鼠中,顺铂诱导的nox3表达细胞的增加和随后发生的药物性听力损失较弱。这一结果与临床数据一致,表明顺铂诱导的听力损失在15岁以下儿童中更常见。
这项研究确定了细胞在内耳耳蜗中表达Nox3(换句话说,耳蜗中超氧化物的起源),并发现诱导的Nox3表达导致外毛细胞凋亡(损失/死亡),从而导致听力损失(老化,噪音和药物相关)。因此,研究人员发现,抑制Nox3的表达或功能可以为预防获得性听力损失的发生提供一种有前途的方法。
进一步发展
听力损失是最常见的感音神经损伤,预计未来只会增加;然而,有必要开发针对这些情况的药物干预措施。本研究揭示了Nox3在内耳耳蜗中产生的超氧化物导致耳蜗细胞凋亡(损失/死亡)外毛细胞,它至少会导致以下类型的获得性听力损失:年龄相关、噪音诱发和药物诱发。结果还表明,通过抑制耳蜗中Nox3的表达和功能,有可能预防主要类型的获得性听力损失的发生。幸运的是,如果这样的Nox3抑制剂被开发出来,它对身体其他部位的副作用可能是轻微的,因为据报道,Nox3在内耳中有特异性表达。
至于基因感音神经性听力丧失在美国,针对每种特定疾病分别开发治疗方法的研究正在取得进展。然而,与获得性听力损失患者相比,遗传性听力损失患者要少得多。
如果能够开发出针对上述三种主要类型的获得性听力障碍的药物治疗方法,这不仅是世界上第一个以药物为基础的听力损失治疗方法,而且还可以帮助开发遗传性听力损失治疗方法听力也是损失。
这项研究的结果代表了治疗药物开发的突破听力损失而且对社会大有裨益。
进一步探索