“坏脂肪”抑制杀手T细胞攻击癌症
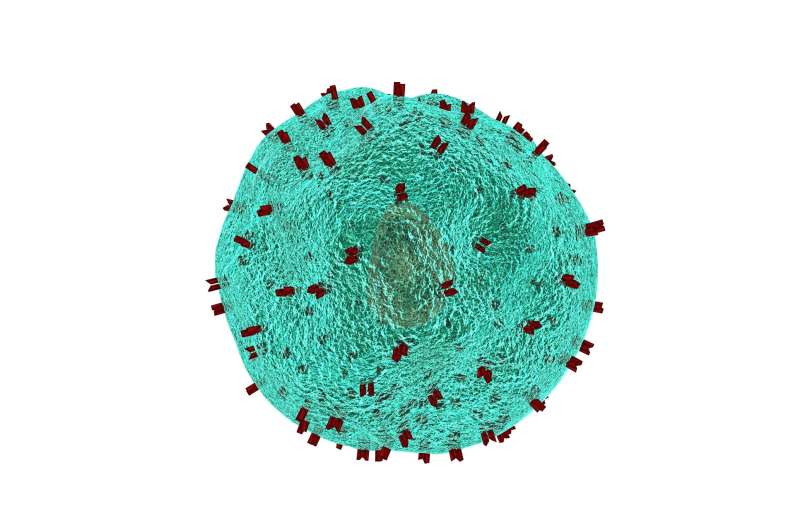
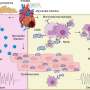
为了让癌症生长和扩散,它必须避开我们的免疫细胞,特别是专门的“杀手”T细胞的检测。由Susan Kaech教授领导的Salk研究人员发现,肿瘤内部的环境(肿瘤微环境)含有大量的氧化脂肪分子,当杀手T细胞摄取这些分子时,会抑制它们杀死癌细胞的能力。在一个恶性循环中,那些需要能量的T细胞增加了细胞脂肪转运体CD36的水平,不幸的是,这种转运体使它们充满了更多的氧化脂肪,进一步削弱了它们的抗肿瘤功能。
这一发现发表在免疫力在2021年6月7日发表的论文中,提出了通过减少氧化来保护免疫系统对抗癌症能力的新途径脂质杀伤T细胞的损伤。识别这些导致免疫抑制的因素肿瘤微环境可能导致新的癌症免疫疗法的发展。
“我们知道肿瘤是一种代谢不利的环境健康的细胞,但说明了哪一个代谢过程是如何抑制免疫细胞功能的,这是癌症研究的一个重要领域,正在获得大量关注,”索尔克NOMIS免疫生物学和微生物发病机制中心的高级作者和主任Kaech说。“我们的研究发现了肿瘤免疫抑制的一种新模式,涉及通过细胞脂肪转运体CD36在T细胞中输入氧化脂肪(又名脂类),这削弱了它们的局部抗肿瘤功能。”
新兴的癌症免疫代谢领域研究免疫细胞代谢是如何在肿瘤内重新编程,并由营养可得性的改变驱动。虽然科学家们知道肿瘤会积累脂肪,而且这种积累与免疫功能障碍有关,但这种关系的细节还不清楚。
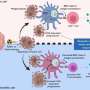
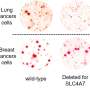
该团队与加州大学圣地亚哥分校Joseph Witztum实验室和索尔克质谱中心的Antonio Pinto合作,发现肿瘤中含有大量的几种脂类,特别是氧化脂类,通常存在于氧化低密度脂蛋白(LDLs)中,通常被认为是“坏”脂肪。然后他们观察了杀伤T细胞对肿瘤中氧化的低密度脂蛋白的反应,发现杀伤T细胞适应了肿瘤微环境通过增加它们表面的CD36和摄入大量氧化脂质。他们与耶鲁大学布林达·埃木的实验室合作,发现这一过程作为催化剂,在杀手T细胞内部推动更多的脂质氧化,最终抑制了它们的防御。
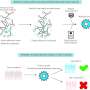
接下来,研究小组采用各种方法来研究CD36是如何削弱杀伤T细胞功能的。他们在T细胞上建立了缺乏CD36的小鼠模型,并用抗体阻断CD36。他们证实,CD36通过增加氧化性脂质输入来促进肿瘤中T细胞功能障碍,这在T细胞内引起了更大的脂质氧化和损伤,并触发了应激反应蛋白p38的激活。
“我们发现,当T细胞受到氧化脂质的‘压力’时,它们会关闭抗肿瘤功能,”索尔克博士后徐世豪(音)说,他也是这篇论文的第一作者。
研究小组还发现了新的治疗机会,可以通过抗体疗法阻断CD36或过表达谷胱甘肽过氧化物酶4 (GPX4,一种去除细胞中氧化脂质的关键分子)的免疫治疗,减少脂质氧化,恢复肿瘤中杀伤T细胞的功能。
重要的是,脂质氧化不仅仅发生在T细胞中;它也发生在肿瘤细胞中,过多的它会导致细胞死亡。事实上,在癌症研究中,将肿瘤细胞中的脂质氧化提高到致命水平是非常令人兴奋的,但Kaech和她的团队敦促人们保持谨慎。
“既然我们已经发现了T细胞对脂质氧化应激的脆弱性,我们可能需要找到更有选择性的方法来诱导肿瘤细胞中的脂质氧化,而不是T细胞中的脂质氧化,”在Salk担任NOMIS主席的Kaech说。“否则,我们可能会破坏抗肿瘤T细胞细胞在这个过程中,我们的工作为如何做到这一点展示了一些有趣的可能性。”
进一步探索