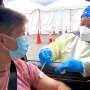
临床试验评估混合COVID-19疫苗计划开始了
美国国立卫生研究院已开始半期临床试验中,成人志愿者已经完全接种COVID-19将收到升压剂不同COVID-19疫苗的安全性和免疫原性混合推动方案。国家过敏症和传染病研究所(NIAID),国立卫生研究院的一部分,和资金研究通过领先传染病临床研究财团临床试验网络,包括研究所长期以来的疫苗和治疗评估单位(VTEUs)。
“尽管目前疫苗经美国食品和药物管理局对COVID-19提供强有力的保护,我们需要准备需要加强注射计数器的可能性减弱免疫和跟上发展的病毒,“董事NIAID说安东尼福奇由医学博士“这个试验的结果旨在告知公共卫生政策决策的潜在的混合使用疫苗时间表升压剂应表示。”
审判由主要研究者Robert l . Atmar医学博士休斯顿贝勒医学院,和克里斯汀•e . Lyke,医学博士马里兰大学学院公园。它将包括大约150人已经收到的三个COVID-19疫苗疗法目前在美国食品及药物管理局紧急使用授权:詹森COVID-19疫苗(也称为强生(Johnson & Johnson)疫苗,或Ad26.COV2-S),现代化COVID-19疫苗(也称为信使rna - 1273),和Pfizer-BioNTech COVID-19疫苗(也称为(BNT162b2)。每个疫苗组将招收大约25人年龄18 - 55岁,大约25人56岁及以上。12到20周后他们的初始疫苗接种方案,参与者将收到一个升压剂现代化COVID-19疫苗试验的一部分。
人未收到FDA授权COVID-19疫苗也有资格参加审判在一个单独的队列。最初,这些志愿者将接受剂治疗现代化COVID-19疫苗疗法,将收到一个升压剂疫苗约12到20周后。
试验有一个自适应设计和可能增加武器作为疫苗是授予欧洲大学协会和/或变异血统评价疫苗可用。
试验参与者将收到最后一次疫苗接种后随访一年,作为这项研究的一部分。他们将被要求完成电话签到和各种现场跟进拜访。试验人员将评估参与者为了安全,接种后任何副作用。参与者也将被要求提供血液样本定期试验调查人员可以评估针对当前循环SARS-CoV-2病毒毒株的免疫反应,以及新兴的变体。如果试验参与者开发实验室确认症状COVID-19,调查人员将会对参与者进行基因序列分析样品,看看SARS-CoV-2的变异株感染引起的。
初步试验结果预计在2021年夏末。关于审判的更多信息,包括注册地点的列表,请访问clinicaltrials.gov和搜索标识符NCT04889209。