FDA批准了备受争议的阿尔茨海默氏症药物
政府卫生官员周一批准了近20年来首个治疗阿尔茨海默病(Alzheimer’s disease)的新药,无视独立顾问的警告,称这种备受争议的治疗方法尚未显示出有助于减缓这种破坏大脑的疾病。
基于研究结果,美国食品和药物管理局(Food and Drug Administration)批准了百健(Biogen)的这种药物,因为研究结果显示,它似乎“有理由”有益于阿尔茨海默症患者。美国监管机构表示,这是唯一一种可能治疗潜在疾病的疗法,而不是控制焦虑和失眠等症状。
这一决定可能会影响数百万美国人和他们的家庭,肯定会在医生、医学研究人员和患者群体中引发分歧。bob88体育平台登录它还对用于评估实验疗法的标准产生了深远的影响,包括那些只显示出增量效益的疗法。
百健与日本卫材公司(Eisai Co.)合作开发的新药并没有逆转智力衰退,一项研究显示,它只是减缓了智力衰退。这种药物名为aducanumab,将以Aduhelm的名称上市,每四周注射一次。
FDA顾问凯莱布·亚历山大(Caleb Alexander)博士曾建议反对批准该药,他说,他对这一决定感到“惊讶和失望”。
“FDA之所以得到尊重,是因为它有基于确凿证据的监管标准。在这种情况下,我认为他们给产品放行了,”约翰霍普金斯大学的医学研究员亚历山大说。bob88体育平台登录
FDA的最高药品监管机构承认,围绕该药物的“残余不确定性”,但表示,Aduhelm减少大脑中有害斑块的能力有望帮助减缓痴呆。
“数据支持患者和护理人员选择使用这种药物,”帕特里齐亚·卡瓦佐尼医生告诉记者。她说,FDA仔细权衡了患有这种“毁灭性、使人衰弱和致命疾病”的患者的建议。
根据所谓的加速批准条款,FDA要求百健进行后续研究,以确认对患者的益处。如果研究未能显示出有效性,FDA可能会将该药物撤出市场,不过该机构很少这样做。
百健表示,这种药物一年的治疗价值约为5.6万美元,并表示四年之内不会涨价。由于保险覆盖范围和其他折扣,大多数患者不会支付接近这个水平的费用。该公司表示,其目标是在2030年之前完成fda授权的后续试验。
消息公布后,百健的股价周一大涨38%,分析师预计未来销售额将达到数十亿美元。这家总部位于马萨诸塞州剑桥市的公司计划在两周内开始运送数百万剂疫苗。
研究药物价值的非营利性机构临床与经济评论研究所(Institute for Clinical and Economic Review)表示,百健的药物必须完全抑制痴呆,才能证明每年5.6万美元的价格是合理的。

美国约有600万人患有阿尔茨海默症,全球范围内有更多的人患有此病,这种疾病会逐渐攻击大脑中负责记忆、推理、沟通和基本日常任务的区域。在该病的最后阶段,患者会失去吞咽能力。这种疾病是痴呆症最常见的病因,随着数百万婴儿潮一代迈入六七十岁,这种疾病的全球负担预计只会增加。
Aducanumab(发音为add-yoo-CAN-yoo-mab)有助于清除大脑中一种叫做β -淀粉样蛋白的蛋白质。其他试验药物也做到了这一点,但它们对患者的思考能力、自理能力或独立生活能力没有任何影响。
多年来,制药行业的药物管道中充斥着阿尔茨海默症治疗失败的药物。FDA周一的批准可能会重启制药商此前搁置的治疗方法的投资。
这种新药是用活细胞制造的,将在医生办公室或医院通过输液给药。
研究人员还不完全了解导致阿尔茨海默症的原因,但人们普遍认为,aducanumab靶向的脑斑块只是原因之一。有证据表明,家族史、受教育程度以及糖尿病和心脏病等慢性疾病都可能起作用。
“这是一个希望的迹象,但不是最终的答案,”美国国家衰老研究所(National Institute on Aging)主任理查德·赫德(Richard Hodes)博士说。该研究所没有参与百健的研究,但为研究阿尔茨海默症的形成机制提供了资金。“淀粉样蛋白很重要,但不是唯一的影响因素。”
服用aducanumab的患者的思维能力下降速度比服用安慰剂的患者慢22%。
但这意味着在18分的认知和功能能力评分中,只相差0.39分。目前还不清楚这些指标如何转化为实际好处,比如增强独立性或回忆重要细节的能力。
FDA对该药的审查已成为长期争论的焦点,争论的焦点是用于评估难治性疾病疗法的标准。一方面,代表阿尔茨海默氏症患者及其家属的团体表示,任何新的治疗方法——即使是收效甚微的疗法——都应该得到批准。但许多专家警告说,批准这种药物可能会开创一个危险的先例,为疗效可疑的治疗打开大门。
尽管FDA的外部神经学专家小组在11月进行了严厉的评估,但该药物还是获得了批准。对于百健提交的一项单一研究的重新分析数据是否表明该药物有效的一系列问题,该小组投了“否”票。
在令人失望的结果表明aducanumab无法达到减缓阿尔茨海默症患者智力和功能衰退的目标后,百健在2019年停止了两项研究。
几个月后,该公司改变了做法,宣布对一项研究的新分析表明,该药物在较高剂量下有效,FDA已建议对其进行审查。该公司的科学家表示,该药物最初的失败是由于一些患者没有接受足够大的剂量来减缓疾病。
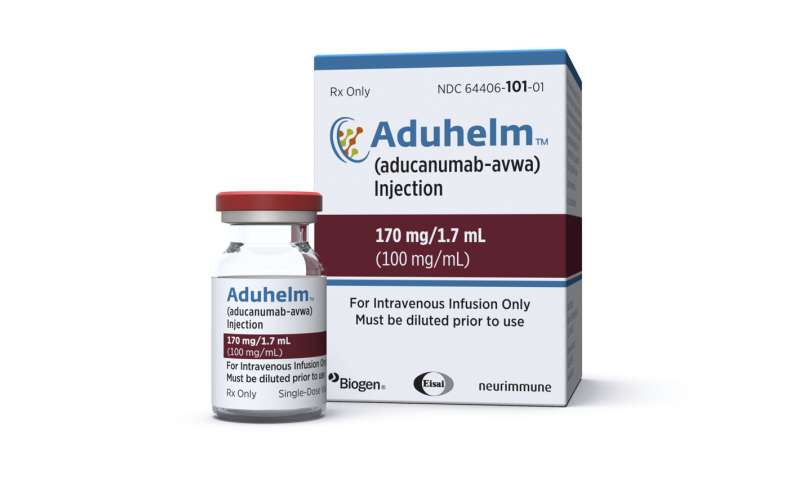
但剂量的变化和该公司的事后分析使得结果难以解释,引发了许多专家的怀疑,包括FDA委员会的专家。
FDA不需要听从外部专家的建议,以前在做出类似备受瞩目的药品决策时,FDA也会忽略他们的意见。
百健表示,大约900家美国医疗机构已经准备好开始开这种药的处方,预计未来几个月还会有更多的医疗机构开这种药。但关键的实际问题仍然存在:病人能受益多久?医生如何决定何时停药?这种药物对晚期痴呆患者有疗效吗?
随着FDA的批准,aducanumab几乎肯定会被大多数保险公司覆盖,包括医疗保险,覆盖超过6000万人的老年人政府计划。
保险公司可以通过要求严格的条件来控制药物的成本,包括在同意承保之前进行脑部扫描以确认斑块。
还需要额外的扫描来监测潜在的副作用。该药带有暂时性脑肿胀的警告,有时会导致头痛、意识混乱和头晕。其他副作用包括过敏反应、腹泻和定向障碍。
虽然百健在轻度痴呆或早期阿尔茨海默氏症患者中研究了这种药物,但FDA的标签批准了这种药物适用于任何阿尔茨海默氏症患者,这一庞大的人群让医生在诊断这种疾病方面有很大的回旋余地。
“FDA授权医生做出诊断决定,”Biogen首席执行官Michel Vounatsos在一次采访中说。
对于已经参加百健的试验的患者来说,周一的公告意味着他们可以继续服用一种许多人认为有帮助的药物。
63岁的菲利普·林恩(Phillip Lynn)在2017年春天被诊断出患有阿尔茨海默症,他在交谈和记忆方面出现问题,包括忘记最近去夏威夷度假。
他的丈夫Kurt Rehwinkel说,自从三年多前开始服用百健的药物以来,林恩的认知能力已经稳定下来。他在短期记忆测试中的表现实际上有所改善,尽管这对夫妇承认,大多数患者不太可能看到类似的结果。
雷温克尔说:“即使对那些没什么影响的人来说,我认为希望也是一件好事。”“我认为不存在虚假的希望。”
©2021美联社。版权所有。未经允许,本材料不得出版、广播、改写或重新分发。