来自患者的运动神经元为渐冻症提供了新的药物靶点
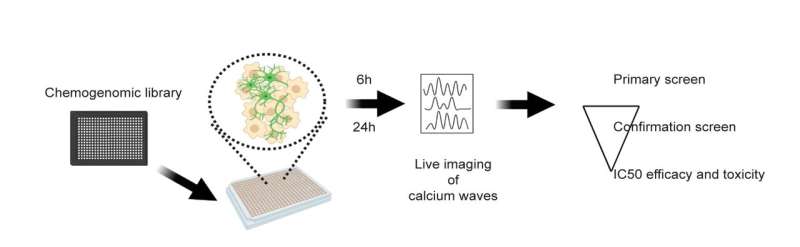
肌萎缩性侧索硬化症(ALS)是一种严重的、致命的神经退行性疾病,导致运动神经元和随意肌肉活动的丧失。虽然小鼠研究已经确定了潜在的治疗方法,但这些药物在人体试验中的表现通常非常糟糕。波士顿儿童医院的研究人员与辉瑞公司合作,现在报告了一个使用渐冻症患者的运动神经元的高通量靶标和药物发现平台。利用该平台,他们确认了两个已知的靶点,并确定了一类现有的药物——多巴胺D2受体激动剂——作为潜在的新治疗方法。
研究人员由克利福德·伍尔夫(Clifford Woolf)博士领导,他是波士顿儿童医院F.M. Kirby神经生物学中心主任,第一作者黄轩博士和Kasper Roet博士在伍尔夫的实验室中描述了该平台和他们6月8日的研究结果细胞的报道.
要创建电动机神经元用于药物筛选时,团队采用诱导性多能干细胞由哈佛大学凯文·埃根(Kevin Eggan)的实验室用携带SOD1(A4V)突变的ALS患者的组织样本制作而成。伍尔夫实验室还开发了一种高通量活细胞成像技术,用于测量运动神经元在接触候选药物前后的过度兴奋性(过度“放电”的倾向)。伍尔夫和他的同事先前证明,ALS突变的人类运动神经元比正常的运动神经元更容易兴奋。
伍尔夫说:“这种过度兴奋性使运动神经元更容易退化,最终死亡。”“我们的成像平台能够快速评估384孔运动神经元板的多动症,并测试细胞对数千种不同药物的反应。”
这项技术被称为GCaMP成像,此前从未大规模用于ALS治疗。GCaMP是神经元中钙水平的荧光报告者,是神经元放电动作电位频率的指示器。
总的来说,研究人员筛选了辉瑞公司的2900种药物库,这些药物都有已知的、带注释的操作。经过三轮筛选,他们发现67种化合物可以降低患者衍生的过度兴奋性运动神经元,不会产生毒性。
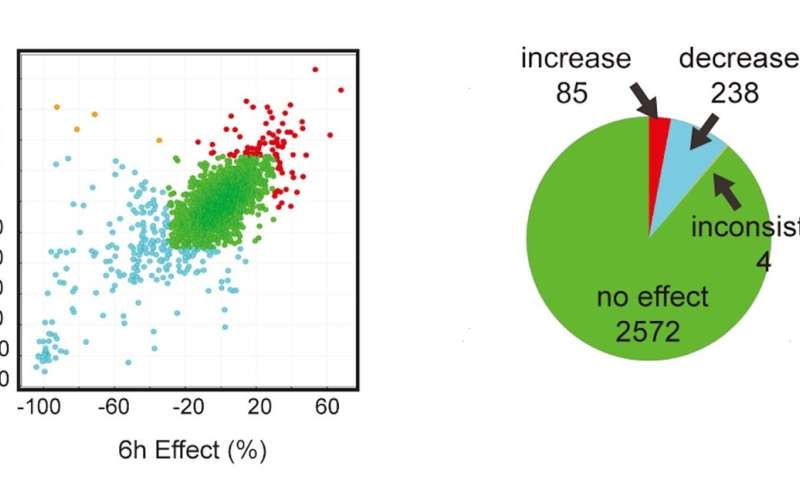
伍尔夫说:“通过进行旨在逆转ALS运动神经元疾病表型(即过度兴奋性)的筛查,我们能够发现新的靶点和疾病机制,并以公正的方式确认其他靶点和疾病机制。”
进一步的研究锁定了13个作用最大的潜在药物靶点,其中7个属于已知与ALS过度兴奋性相关的两类(AMPA受体和Kv7钾通道)。在最近的一项临床试验中,发现Kv7通道开放药物可降低ALS患者的运动神经元过度兴奋性。由伍尔夫、Eggan和Roet共同创立的quuralis公司正在开发这些药物作为ALS的治疗方法。
目前的研究还发现了一种有前途的新型候选药物,多巴胺D2受体(DRD2)激动剂。这些受体在运动神经元超兴奋性中的作用以前没有被认识到。一些DRD2激动剂(溴隐亭、素曼role)已上市,为ALS患者使用它们开辟了可能性。
伍尔夫说:“我们的研究结果表明,神经元兴奋性筛选是发现相关可药物靶点的强大平台。”“我们相信它可以应用于其他领域神经系统疾病涉及神经元兴奋性,如癫痫和阿尔茨海默病等其他神经退行性疾病。”
伍尔夫继续使用人类神经元筛选平台来确定治疗疼痛和神经病的新靶点。
他说:“药物发现中最困难的挑战之一是确定在疾病过程中起关键作用的靶点。”“使用患者来源的神经元来模拟疾病,并测试大量已知靶点的化合物,可以成为开发新疗法的驱动力。”







用户评论