减少tau蛋白是否能预防帕金森氏症和路易体痴呆?

发表在该杂志上的一项新研究eNeuro他认为答案是否定的。如果这一结论得到证实,其结果与阿尔茨海默病不同,阿尔茨海默病是指降低大脑神经元中内源性tau蛋白水平对多种疾病模式具有保护作用。这进一步表明,tau蛋白在路易体痴呆发病机制中的作用与阿尔茨海默病不同。
帕金森病痴呆和路易体痴呆都以细胞内错误折叠聚集为特征α-突触核蛋白的蛋白质在大脑神经元这两种疾病加在一起是神经退行性痴呆的第二大常见原因,仅次于阿尔茨海默症。
阿拉巴马大学伯明翰分校的研究人员,由神经学副教授Laura Volpicelli-Daley博士带领,使用了她在11年前开发的帕金森病模型。Volpicelli-Daley使用极低浓度的改变α-突触核蛋白在体外或体内的神经元中,它已经呈现出病理构象。的神经细胞取一些纤维。在细胞内部,被改变的α -突触核蛋白就像种子一样吸引神经元中自然存在的可溶性α -突触核蛋白。这将可溶性的α -突触核蛋白转化为病态的,不溶性的聚集物,损害神经元功能并导致细胞死亡.这些修饰过的α -突触核蛋白包涵体的形态与死后帕金森病患者大脑中发现的相同。
这种疾病模型被称为模板化α -突触核蛋白包涵体形成,用来比较产生正常数量tau蛋白的神经元和缺乏一个或两个tau蛋白基因的突变神经元,从而产生较少或没有tau蛋白。如果内源性tau蛋白有助于疾病进展,杂合或敲除tau蛋白突变体有望显示保护作用。然而,UAB的研究人员发现与野生型对照没有区别。
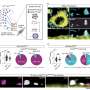
在他们的研究结果中,研究人员首先表明在细胞中tau蛋白和α突触核蛋白之间确实存在相互作用——这两种蛋白质都位于原代培养神经元的突触前末端和小鼠大脑皮层中,这与之前从人脑制备中发现的结果一致,也与几项体外研究显示的两种蛋白质相互作用一致。
然而,tau蛋白的减少或完全缺失并不能阻止体外生长的原代海马神经元中纤维蛋白诱导的α -突触核蛋白包涵体的形成。在小鼠中,tau蛋白的减少或缺失也不能阻止大脑运动控制区或边缘区(包括皮层、杏仁核、海马和黑质致密部)中纤维蛋白诱导的α -突触核蛋白的形成,这是在纤维蛋白注射6周或6个月后测量的结果。
最后,当小鼠模型中的α -突触核蛋白原纤维导致产生神经递质多巴胺的野生型神经元的一半死亡时,奶牛杂合子或奶牛敲除小鼠的多巴胺能神经元显示出同样数量的神经元死亡,这意味着没有保护。此外,减少tau蛋白对含有纤维蛋白诱导的α-突触核蛋白包涵体的小鼠的行为表型没有任何重大影响。
“在这里,我们已经证明内源性tau蛋白的减少并不影响模板α -突触核蛋白包涵体的形成或多巴胺的损失神经元Volpicelli-Daley说。“这表明,针对帕金森病的tau蛋白治疗可能比减少tau蛋白更复杂。这与阿尔茨海默病不同,在阿尔茨海默病中,减少tau蛋白被认为是一种可能的治疗方法。”
进一步探索