FDA要求调查负责人阿尔茨海默氏症药物审查
代理美国食品和药物管理局负责人周五呼吁政府调查极不寻常的接触她的机构的药物评论家和有争议的新的阿尔茨海默氏病药物的制造商。
简妮特博士通过推特宣布非凡的一步。这是最新的后果在上个月的Aduhelm批准,一个昂贵的和未经证实的治疗,该机构可以对自己的外部专家的建议。
丘鹬要求卫生和人类服务部的检察长,监督机构监督FDA和其他联邦卫生机构。此前众多呼吁调查批准从医学专家,消费者维权人士和国会议员。两个国会委员会已经推出了自己的评论。
“我们认为一个独立的评估是最好的方式,以确定任何制造商之间发生的相互作用和该机构的审查人员都符合FDA的政策和程序,”伍德考克写了在Twitter上。生原体承诺将配合调查。
上个月,健康新闻网站统计报道了异常密切Aduhelm制药商生原体和FDA工作人员之间的协作。网站报道,尤其是一个“灰色”的会议在2019年5月生原体高管和美国食品及药物管理局首席评论员对阿尔茨海默氏症的药物。
会议之后生原体停止了两项研究,因为药物似乎并不慢病。一起,FDA开始重新分析数据,总结药物可能会工作。协作最终导致了药物的条件批准两年后,根据它减少粘性斑块的形成大脑中被认为扮演一个角色在阿尔茨海默氏症。
FDA与医药行业人员严格控制,几乎总是认真记录。目前还不清楚如果违反了2019年5月会议机构规则。
当生原体和FDA药品之前,FDA的外部顾问小组去年11月,该组织几乎一致敦促其拒绝。
FDA并不需要遵循集团的建议。和美国食品药品监督管理局领导员工点评者一直在使用几个月生原体药物的data-called“特别有说服力,”“强烈积极”和“健壮”。
消费者组织公民呼吁调查11月之后的合作咨询会议。集团的卫生主管Michael Carome欢迎丘鹬博士的申请调查。
“我们高兴地看到,终于她这个要求应该是几个月前,“Carome说。“不恰当的合作的迹象已经清楚我们11月以来。”
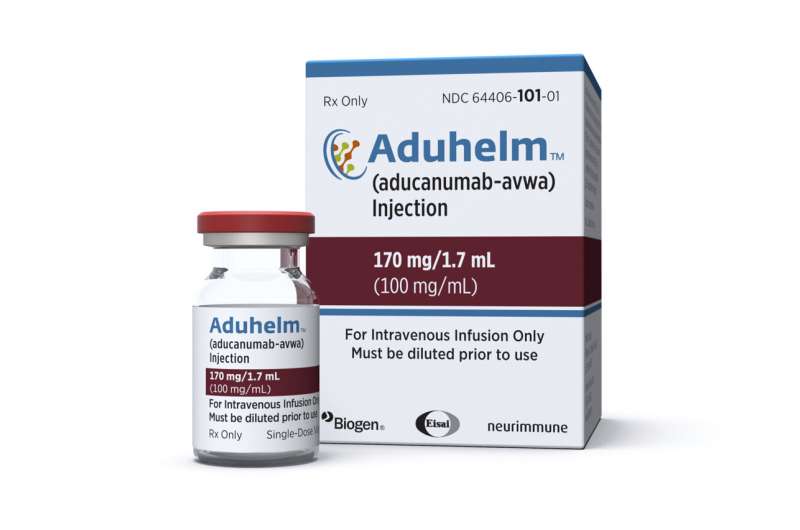
FDA已面临强烈的反对自批准药物,每年花费56000美元,需要每月的静脉注射。
三位FDA顾问反对毒品辞职的决定。在其他问题上一样,他们抗议,该机构没有透露它正在考虑批准该药物在有条件的基础上,根据其影响的大脑斑块,而不是任何实际好处的病人。Aduhelm是第一个老年痴呆症药物的批准。
“我认为所有的不同部分为一项独立调查的决定是值得的,”哈佛大学研究员Kesselheim亚伦博士说的三个顾问辞职。“相信我们在FDA做出独立决策的能力是非常重要的。”
周四,美国食品和药物管理局采取了不同寻常的步骤大大缩减在药物处方信息。该机构和生原体宣布新的标签建议只给患者轻度或早期阿尔茨海默氏症。后很多医生批评原标签太广泛,因为它说,药物可以给任何阿尔茨海默氏症。
Aduhelm没有显示显著逆转或减缓疾病。但是FDA说减少丛生的大脑斑块的能力可能会减缓老年痴呆症。20多个其他药物之前试过这种方法没有产生积极的结果。生原体需要进行后续研究明确回答是否确实有效。其他阿尔茨海默氏症药物只是暂时缓解症状。
丘鹬一直自今年1月以来担任该机构代理专员。以前她花了超过25年的指挥机构的药物中心。虽然政府和中广受尊敬药物行业的圈子里,她常常也被批评为积极推动批准新疗法,即使他们的好处并不确定。
©2021美联社。保留所有权利。材料可能不会被出版,广播,重写或重新分配。