帕金森病:溶酶体如何成为病理传播的中心
在过去几十年里,神经退行性疾病成为全球十大死亡原因之一。了解神经退行性疾病的发病机制,是开发有效治疗这些不治之症的关键。然而,我们对神经退行性疾病发病的基本分子机制仍缺乏了解。一组研究人员发现了溶酶体在帕金森氏症传播中的作用。
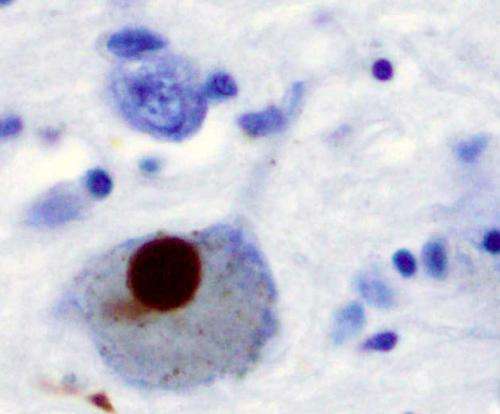
错误折叠蛋白聚集物在受影响的大脑区域的积累是几种神经退行性疾病(NDs)的共同特征。在细胞和动物模型中,越来越多的证据强调了不同错误折叠蛋白的传输能力和诱导其内源性对应蛋白聚集的能力,这个过程被称为“播种”。在第二常见的帕金森病中,错误折叠的α-突触核蛋白(α-syn)在神经元内的纤维聚集物中积累。这些堆积被称为路易小体。
α-syn原纤维通过溶酶体内的tnt扩散
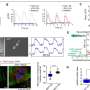
2016年,来自巴斯德研究所(巴黎)和法国国家科学研究中心(法语:CNRS, National de la recherche scientique)的一组研究人员证明,α- syn原纤维通过隧道纳米管(tnt)从供体细胞扩散到受体细胞。他们还发现这些原纤维是通过溶酶体内的tnt转移的。“tnt是肌动蛋白为基础的膜通道,允许多种细胞成分(包括细胞器)在遥远的细胞之间转移。溶酶体是通常委托降解和回收有毒/受损细胞物质的细胞器”,巴斯德研究所膜运输和发病机制部门负责人Chiara Zurzolo说。
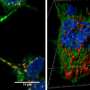
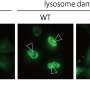
α-syn纤维可以改变溶酶体的形状和通透性,使其能够播撒和扩散
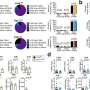
根据这一最初的发现,研究人员现在对溶酶体如何通过tnt参与α-syn聚合体的扩散有了一些了解。“通过使用超分辨率和电子显微镜,我们发现α-syn纤维影响溶酶体的形态,并损害它们在神经元细胞中的功能。我们首次证明α-syn原纤维诱导溶酶体的外周重分布,从而增加α-syn原纤维向邻近细胞转移的效率,”Chiara Zurzolo继续说。α-syn原纤维可以渗透溶酶体膜,削弱溶酶体的降解功能,使可溶性α-syn种子主要发生在溶酶体中。因此,通过破坏溶酶体功能,α-syn原纤维阻断了自身在溶酶体中的降解,而成为病理传播的枢纽。
通过破坏溶酶体功能,α-syn原纤维阻断了自身在溶酶体中的降解,从而成为病理传播的枢纽。这一发现有助于阐明α-syn原纤维通过tnt传播的机制,同时也揭示了溶酶体的关键作用,在播撒和繁殖中起着特洛伊木马的作用疾病病理这些信息可以用来建立针对这些不治之症的新疗法。
进一步探索