发现RETT综合征背后的遗传机制
bob88体育平台登录九州大学领导的医学研究人员揭示了RETT综合征神经功能障碍背后的潜在遗传途径。该小组发现,涉及病理学的关键基因缺陷会触发神经干细胞,从而通过产生更多的星形胶质细胞(大脑的维持细胞)来产生更少的神经元。
研究人员希望他们鉴定出的分子病理,如杂志报道细胞报告,将来可能导致RETT综合征的潜在治疗靶点。
RETT综合征是一种进行性神经发育障碍,其特征是认知和协调方面的障碍(与严重程度不同),每10,000至15,000名女性出生中大约有1个。但是,最初很难识别,因为在最初的6-18个月中,儿童似乎正常发育。
“ RETT综合征是由突变引起的单基因叫甲基-CPG结合蛋白2, 或者MECP2。该基因在二十年前被确定,此后已经发现了很多东西,但是确切的突变如何引起病理仍然难以捉摸。”
在过去的研究中,该小组确定MECP2是处理特定microRNA以控制神经元功能的调节剂。因此,他们回去调查该途径是否也参与了神经干细胞。
与Messenger RNA相比,从细胞使用的DNA转录的最终模板用于合成蛋白质,microRNA(或miRNA)较小,并且可以调节Messenger RNA,以确保细胞制造正确量的所需蛋白质。
Nakashima说:“通过我们的研究,我们发现了几种与MECP2相关的microRNA,但只有一个影响神经干细胞的分化:一种称为miR-199a的microRNA,” Nakashima说。“实际上,当MeCP2或MiR-199a被破坏时,我们发现它增加了称为星形胶质细胞的细胞的产生。”
星形胶质细胞就像大脑的支撑细胞一样。神经元开火电信号,星形胶质细胞有助于维护其他一切。在发育过程中,星形胶质细胞和神经元是由相同类型的干细胞(称为神经干细胞)产生的,它们的产生得到了仔细控制。然而,MECP2或miR-199a的功能障碍会导致这些干细胞产生的星形胶质细胞比神经元更多。
“进一步的分析表明,miR-199a靶向蛋白质SMAD1,这是一种适当细胞发育至关重要的转录因子。SMAD1在一种称为BMP信号传导的途径下游功能,已知该途径抑制神经元的产生并促进星形胶质细胞的产生,”中岛。
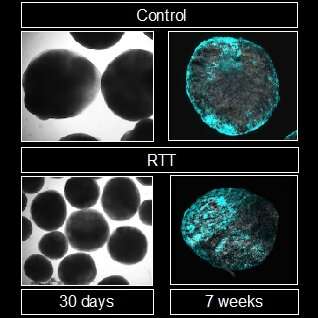
为了进一步研究这一过程,团队建立了脑器官培养物(神经干细胞的3D培养物,可以模仿大脑发育方面)细胞源自RETT综合征患者。当他们抑制BMP时,骨形态发生蛋白的缩写缩短了,该团队能够减少异常的神经干细胞分化。
负责团队的Kinichi Nakashima总结说:“我们的发现使我们对MECP2,MiR-199a和BMP信号在RETT综合征的病理学中的作用有了宝贵的了解。”“需要进一步调查,但我们希望这可以导致RETT的临床治疗综合征症状。”