揭示白血病中产生个性化代谢的机制
熊本大学(日本)的一项研究合作表明,赖氨酸特异性去甲基酶1 (LSD1),一种参与基因表达的酶,根据急性髓系白血病细胞的类型产生个性化的代谢。众所周知,癌细胞具有与正常细胞不同的独特代谢物质的能力,这种能力被认为是一种有前途的治疗靶点。新的研究结果可能有助于安全有效地使用LSD1抑制剂作为潜在的抗癌药物,以及开发针对各种白血病类型的高度特异性治疗方法。
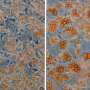
急性髓性白血病(AML)发生在造血干细胞变成肿瘤而不是分化成白细胞或红细胞。不同类型的AML根据其癌变的分化阶段而发展。在分化为红细胞时发生的白血病被归类为红母细胞白血病(EL)。尽管针对某些AML形式的病理特异性靶向分子疗法已经开发出来,并改善了治疗结果,但由于缺乏个性化治疗,包括EL在内的许多形式的疾病具有很高的死亡率。因此,需要基于疾病类型和分子病理学的治疗方法。
近年来的研究表明,癌细胞固有的代谢能力对肿瘤的形成、转移和治疗的耐药性有重要的影响。因此,针对营养转运和代谢途径在癌细胞中的活性已经被设计出来,但也有人指出,代谢特征取决于癌症的类型和进展。AML的代谢特征尚未得到充分研究,特别是依赖于疾病类型的差异及其机制尚未阐明。
基因表达受表观基因组调控。化学修饰,如DNA甲基化和DNA包裹的组蛋白的甲基化,作为塑造表观基因组的标记。在表观基因组上有很多不同癌症细胞而且正常细胞这反过来又产生了基因表达模式的差异。
此前,熊本大学科研合作显示LSD1,一种从甲基化组蛋白中去除甲基的去甲基酶,参与调节各种细胞类型的能量代谢(自然通讯2012年,癌症研究2015,核酸研究2018)。因此,他们决定测试LSD1参与AML细胞代谢调节的可能性。虽然已经证明LSD1抑制剂在AML治疗中可能有效,但对不同疾病类型的疗效差异知之甚少。因此,在这项研究中,研究人员决定关注取决于AML疾病类型和LSD1作用的代谢差异。
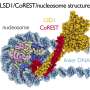
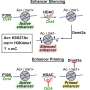
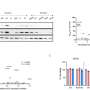
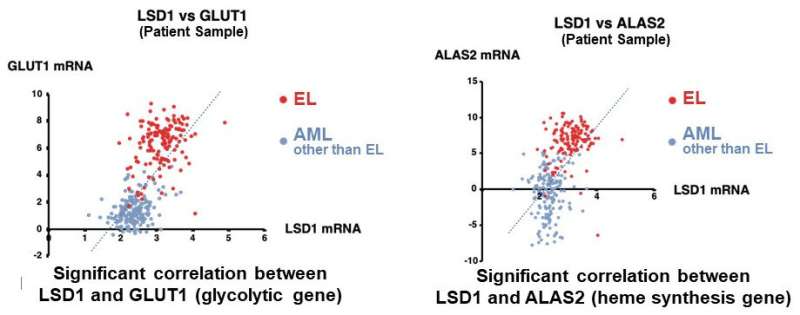
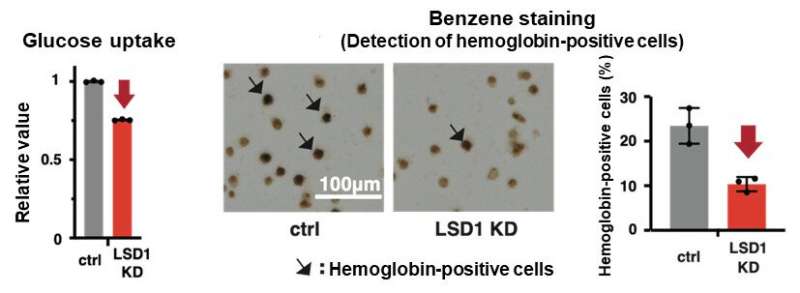
他们首先分析了AML患者和AML源性培养细胞株的基因表达数据库,发现LSD1和糖酵解基因在AML患者的EL中都有高表达。然后,当他们使用EL细胞系测试LSD1功能的抑制时,他们发现LSD1促进葡萄糖摄取细胞还有糖酵解系统。综合组学分析显示,血红素合成是正常代谢途径的特征红细胞,也被LSD1激活。其机制是LSD1激活糖酵解和血红素合成基因表达通过阻止GATA1蛋白的降解,GATA1蛋白是一种红细胞转录因子。
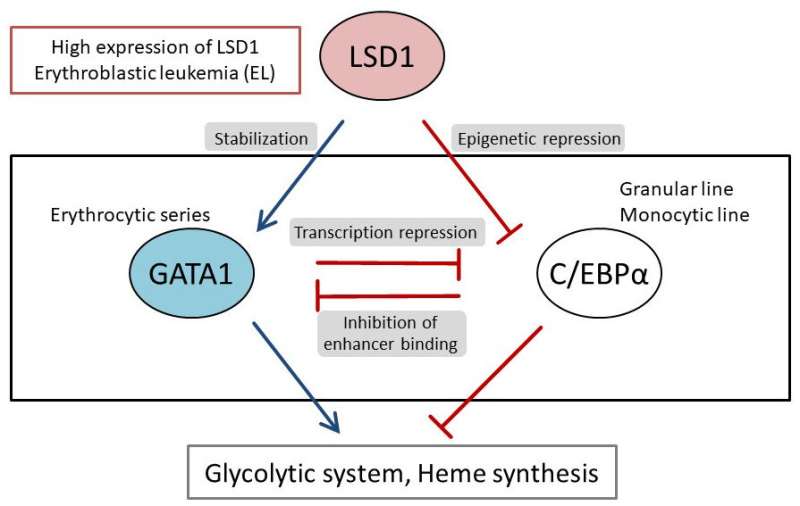
此外,在LSD1功能抑制下,白细胞中粒细胞-单核细胞谱系的转录因子CEBP/α的表达显著上调,抑制了GATA1的代谢调节。这些结果表明,LSD1调控了参与造血细胞谱系的转录因子的平衡,从而产生了EL的代谢表型特征。此外,对不同类型AML的临床资料分析表明,LSD1、GATA1、糖酵解和血红素合成基因的表达呈显著正相关。这表明LSD1对细胞谱系的调控可能导致AML代谢类型的多样性。
“根据我们的研究,LSD1抑制剂、代谢靶标药物和常规疗法的组合可能对治疗表达高水平LSD1的EL患者非常有效,”领导这项研究的副教授Shinjiro Hino说。“这也可能是在临床试验中选择可能受益于LSD1抑制剂的患者的重要线索。”
这项研究发表在血液的进步2021年4月30日。
更多信息:Kensaku Kohrogi等人,LSD1通过控制谱系特异性转录因子GATA1和C/EBPα来定义红白血病代谢,血液的进步(2021)。DOI: 10.1182 / bloodadvances.2020003521