新见解形成的有毒蛋白质聚集在阿尔茨海默氏症
小聚集的蛋白质称为Aβ寡聚物被怀疑为主要原因阿尔茨海默氏病的发展。然而,目前尚不清楚,和在什么条件下这些有毒的聚合形式。海因里希海涅大学的研究人员和j Forschungszentrum杜塞尔多夫大学一起合作伙伴和科隆大学医院,现在已经发现,微酸性环境有利于发展。在这样的环境下,低聚物的形式比中性pH值,快8000倍的科学家写日记自然通讯。这样的稍微降低pH值也可以在某些子结构的神经细胞。
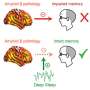
阿尔茨海默病的确切原因尚未完全理解尽管密集的研究。几十年来,有一个关注的特点蛋白质存款老年痴呆症患者的大脑中,可以清楚地看到一个显微镜。今天,研究人员而不是专注于这些存款的“小亲戚”,低聚物。这些也是积累的淀粉样β蛋白肽(Aβ),但在一个小得多的规模通常由几个单位。
Aβ本身不是有害的,也可以在健康个体中找到。它倾向于组装成有毒的结构,例如,代谢过程扰乱了大脑。触发这些有毒的寡聚物的生化过程被认为是阿尔茨海默氏症的原因。然而,目前尚不清楚在哪里以及如何这些寡聚物的形式。体外,它尚未在现实条件下可能的复制过程。所需的大量Aβ这样做是大大高于那些可以在大脑中检测到的液体。
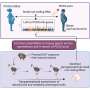
已经发表的研究中,研究人员能够表明,低聚物的发展高度依赖于pH值。在微酸性条件下,它们形成更快比中性pH值的8000倍。这种情况可以发现,例如,在某些子结构细胞被称为核内体和lysosomes-small泡沫或囊泡运输及降解中发挥核心作用的物质在细胞中。
“这些细胞区域中的大量Aβ因此足以使Aβ寡聚物的形成,“解释海因里希海涅大学的沃尔夫冈·霍耶杜塞尔多夫和Forschungszentrum j。
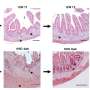
核内体和溶酶体一直是阿尔茨海默氏症研究的一个焦点。这些网站,个人Aβ分子发展首先通过前体蛋白的分解。他们也装配点,Aβ吸收细胞的运输。“现在我们的结果表明,核内体和溶酶体的网站Aβ优先形成低聚物,“霍耶解释道。
研究提供了解释蛋白质的分布不均
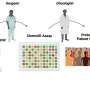
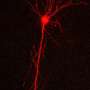
研究人员还可以建立一个联系有毒Aβ寡聚物和阿尔茨海默病的另一个特点。后添加Aβ寡聚物,他们观察到一个错误的τ蛋白在神经细胞内的分布。τ蛋白是第二个蛋白质与阿尔茨海默病的进展密切相关。它出现在错误的地点会导致破坏神经细胞的活动和结构。
“τ蛋白的分布不均和其他病变至关重要的损失函数的神经细胞和阿尔茨海默氏症患者的认知障碍。这里描述的事实Aβ寡聚物可以触发这个tau蛋白的病变神经细胞突显出高病理生理研究的相关性,”解释了汉斯Zempel科隆大学医院。
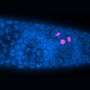
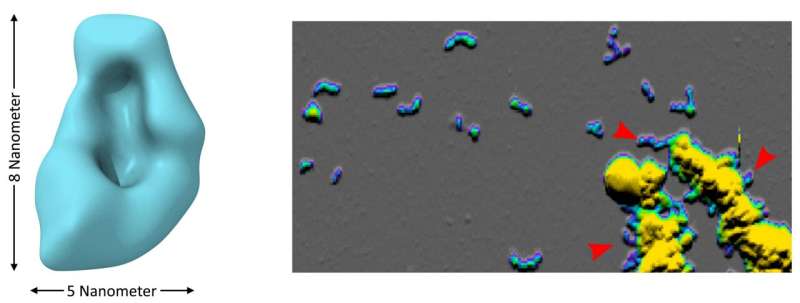
的研究团队也能够调查的规模和形式寡聚物通过低温电子显微镜和原子力显微镜。”获得的研究结果提供了一个基础来获得更好的理解的特殊性质和影响这些关键蛋白聚集,“霍耶说。这将有助于诊断和治疗策略的发展具体目标低聚物。
更多信息:玛丽·Schutzmann et al Endo-lysosomal Aβ浓度和pH值触发Aβ形成低聚物,强有力地诱导τ串户,自然通讯(2021)。DOI: 10.1038 / s41467 - 021 - 24900 - 4